Проблема заболеваемости воздушно-капельными инфекциями, в том числе острыми респираторными вирусными (ОРВИ), в Российской Федерации была и на сегодняшний день остается весьма актуальной. Несмотря на постоянное совершенствование мер, направленных на повышение уровня вакциноуправляемости этих инфекций, и создание новых препаратов для повышения эффективности неспецифической иммунорезистентности человека, ежегодно отмечается достаточно высокий уровень заболеваемости. В России только гриппом и ОРВИ каждый год болеют около 30 млн человек, при этом экономические последствия составляют десятки миллиардов рублей [1, 2].
На сегодняшний день важным направлением профилактики распространения инфекций с воздушно-капельным механизмом передачи возбудителя является создание средств для дезинфекции воздуха индивидуального пользования. Применение таких средств для обеззараживания воздуха в зоне дыхания человека позволит значительно снизить риск заражения при нахождении в местах массового скопления людей, при общении с носителями инфекций, уже заболевшими людьми или лицами, находящимися в инкубационном периоде развития инфекции.
Одним из таких средств, позволяющих эффективно обеззараживать воздух в зоне дыхания человека, является обеззараживатель воздуха (генератор диоксида хлора – ДХ) «Барьерный риф» производства «Global Product Planning Co., Ltd» (Япония). Средство представляет собой картридж с перфорациями, внутрь которого помещено активное вещество, содержащее хлорит натрия. При вскрытии упаковки начинается медленное испарение активного компонента (ДХ), обладающего антимикробной активностью, и в зоне дыхания человека создается «купол чистоты», объем которого в закрытом помещении составляет около 1 м3.
ДХ обладает высокой активностью в отношении широкого спектра микроорганизмов: бактерий, вирусов, грибов, спор бацилл. Обеззараживатель воздуха, действуя в низких, малотоксичных концентрациях, проявляет высокую активность в отношении разных вирусов, в частности, вирусов гриппа, в том числе типа А (включая А H5N1, А H1N1), являющихся наиболее частой причиной возникновения ОРВИ у человека.
В лабораторных исследованиях установлена эффективность средства в отношении бактерий, например, золотистого стафилококка, являющегося наиболее устойчивым к дезинфицирующим средствам представителем возбудителей инфекций дыхательных путей и также играющего значительную роль в развитии различных инфекционных состояний, способного передаваться от человека человеку через воздушную среду.
Эффективность и безопасность использования генератора ДХ подтверждена многими лабораторными исследованиями в России и за рубежом. На базе ФБУН «НИИ дезинфектологии» Роспотребнадзора (Москва) в рамках предрегистрационных испытаний данного средства была проведена серия научных экспериментов по оценке его эффективности и безопасности применения для обеззараживания воздуха. Для оценки эффективности средства была использована аэрозольная камера, в рабочем объеме которой размещали изделие «Барьерный риф» и создавали аэрозоль культуры Staphylococcus aureus (шт. 906), который используется в качестве тест-микроорганизма при изучении дезинфицирующих средств, предназначенных для обеззараживания воздуха в помещениях1.
Результаты испытаний показали, что уже через 60 мин степень контаминации воздуха тест-микроорганизмом снижается на 64,2%, через 2 ч – на 77,5%, через 4 ч – на 90,8% по сравнению с контрольными показателями обсемененности воздуха с учетом коэффициента естественной седиментации.
В ФГБУ «НИИ гриппа» Минздрава России была проведена оценка вирулицидной активности генератора ДХ в отношении вируса гриппа. В испытаниях использовали вирус гриппа А/California/07/09 (H1N1)pdm09 из коллекции вируных штаммов ФГБУ «НИИ гриппа» Минздрава России [3].
Результаты исследований свидетельствуют о снижении титра вируса в пробах воздуха в присутствии обеззараживателя через 1–3 мин на 90%, через 3–5 мин – на 97% и через 10–12 мин – на 99%.
Достоинством тестируемого средства является и простота применения. Для его активации необходимо вскрыть герметичную алюминиевую упаковку и извлечь картридж. Максимальная эффективность достигается через 24 ч после активации и сохраняется в течение не менее 30 суток.
Для создания максимальной эффективности необходимо использовать 2 картриджа. Нужно помнить, что на открытом воздухе эффективность обеззараживания может снижаться вследствие влияния воздушных потоков.
Для удобства ношения средства рекомендовано использовать специальную ленту с держателем на шее или специальный держатель для закрепления картриджа на одежде. Вставляют картридж в держатель так, чтобы отверстия держателя были направлены наружу. На активированном картридже отмечают дату начала его использования. Через 30 суток использованные картриджи утилизируют и заменяют на новые.
Токсикологическое воздействие ДХ на организм
Газообразный ДХ обладает мощным антимикробным действием в очень низкой концентрации. Так, было продемонстрировано, что антимикробное действие газообразного ДХ проявляется при концентрации от 0,01 до 0,03 мг/м3 [4–5]. При этом остается неизвестным, является ли безопасным хроническое воздействие газообразного ДХ на организм в концентрациях, эффективных для борьбы с микроорганизмами. В этой связи было выполнено исследование ингаляционной токсичности ДХ в низкой концентрации при долговременном воздействии на экспериментальных животных. При ингаляции ДХ в первую очередь воздействию подвергаются верхние дыхательные пути, соответственно было изучено воздействие ДХ на эпителий трахеи и легких. Наконец, воздействие ряда химически активных веществ на органы дыхания практически всегда сопровождается окислительным стрессом в этих органах [6, 7]. Для нейтрализации негативных последствий в органе активируются различные звенья антиоксидантной системы [8], поэтому исследуя динамику экспрессии генов ферментов-антиоксидантов органа, мы можем характеризовать как сам окислительный стресс, так и основные звенья, ответственные за его нейтрализацию.

Материалы и методы
В экспериментах были использованы крысы линии «Вистар» мужского пола весом 200-220 г. В качестве источника ДХ был применен серийный обеззараживатель воздуха (генератор ДХ) «Барьерный риф».
Животных помещали в клетки, расположенные в камере размером 75 х 75 х 80 см при температуре 24°C и относительной влажности воздуха 7 %, с 12-часовым циклом чередования светлого и темного времени суток. Генератор ДХ был расположен на расстоянии 25 см от верха клеток. Животных выдерживали в атмосфере ДХ в течение определенного времени. В случае суточных экспериментов через 5 ч после каждого воздействия генератор ДХ из камеры удаляли. При исследовании хронического воздействия ДХ генератор находился в камере в течение всех 30 дней.
Все эксперименты над животными проводили в строгом соответствии с требованиями Руководства по обращению с лабораторными животными РФ и Руководством по работе с животными сотрудниками ИБК РАН (утверждено приказом директора ИБК РАН № 57 от 30.12. 2011).
Перед забоем животных наркотизировали путем внутрибрюшинного введения раствора диэтилбарбитуровой кислоты из расчета 10 мг на 100 г массы животного. Выделенную ткань для экспериментов немедленно помещали в жидкий азот. Для одновременного гистологического анализа и анализа экспрессии генов на одном животном в случае трахеи для гистологии брали верхнюю половину трахеи, для анализа уровня экспрессии генов –нижнюю половину трахеи.
Гистологические исследования проводили на парафиновых срезах по стандартной методике. Выделенные образцы ткани закрепляли в фиксаторе Mirsky’s Fixative («National Diagnostics», США) с последующей проводкой в соответствующих растворах и заключении в парафин. Срезы толщиной 2–5 мкм получали на криотоме HM 325 Microm («Thermo Scientific», Германия). и окрашивали гематоксилином-эозином (Hematoxylin-Eozin according to Ehrlich, «Fluka», США). Для выявления муцина и клеток, его секретирующих, срезы окрашивали альциановым синим. Дальнейший анализ проводили на световом микроскопе Leica DM 6000 B («Leica Microsystems», Германия) с помощью камеры Leica DFC 420 C.
Для определения малонового диальдегида (МДА) Предварительно замороженную в кельвинаторе до -80 оС ткань (легкие) размалывали до пылеобразного состояния (с использованием жидкого азота). К 100 мг образца добавляли 3 мл 1% H3PO4, 1 мл 0,8% водного раствора тиобарбитуровой кислоты (ТБК), нагревали смесь на кипящей водяной бане в течение 45 мин. После охлаждения добавляли 4 мл н-бутанола и отделяли слой бутанола путем центрифугирования. Оптическую плотность определяли при длине волны 535 нм по сравнению с контрольными образцами без добавления ткани.
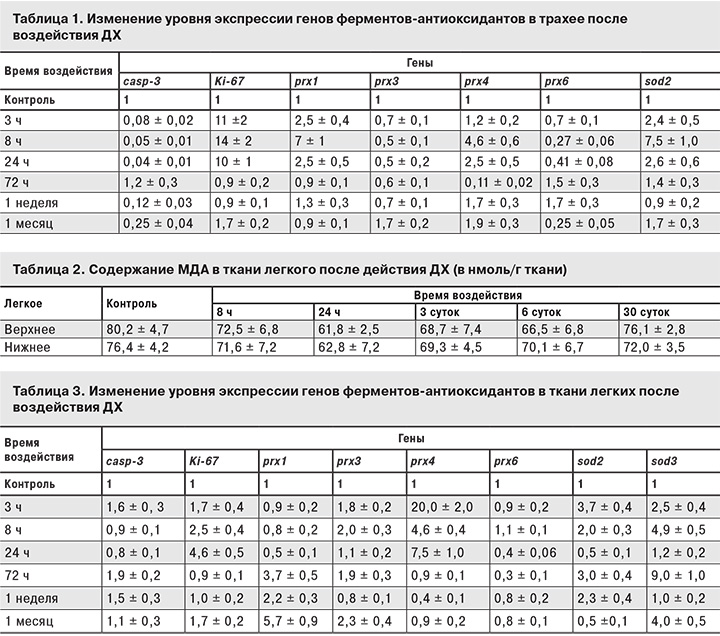
В трахее и легких анализировали экспрессию генов для 15 основных ферментов-антиоксидантов: глутатионпероксидаз 1–8, пероксиредоксинов 1–6, супероксиддисмутаз 1–3 и каталазы. Также исследовали уровень экспрессии генов для маркера апоптоза клеток (сaspase-3) и клеточного маркера пролиферации клеток (Ki-67). Использовали ген-специфические праймеры, синтезированные согласно их последовательностям в GenBank. Уровень экспрессии определяли методом ОТ ПЦР (обратная транскрипция + ПЦР) в реальном времени. Нормирование проводили относительно гена фактора элонгации EFIα или гена β-актина – Аctb.
Статистический анализ выполняли с использованием программы SigmaPlot 11.0 Sortware. Результаты выражали как среднее значение (М) ± стандартная ошибка (m). Показатели считали статистически достоверными при p < 0,05.
Результаты
Влияние ДХ на состояние эпителия трахеи
Так как первой мишенью при действии ДХ является трахея, в первую очередь исследовали изменения в структуре ее эпителия под воздействием ДХ. В нормальном состоянии эпителий трахеи представлен реснитчатыми, бокаловидными (секреторными) и базальными клетками (см. рисунок, а). В случае пребывания животных в атмосфере ДХ в период до 6 суток общих изменений в структуре эпителия не обнаружено: наблюдается полная сохранность эпителия, плотность клеток остается неизменной, хорошо видны реснички в апикальной части реснитчатых клеток. При воздействии ДХ происходит набухание бокаловидных клеток, что свидетельствует об активации секреции этими клетками. Максимум активации регистрировали через 8 ч после действия ДХ, однако через 3 суток она существенно уменьшается, что свидетельствует об адаптации клеток к воздействию (см. рисунок, б, в). При непрерывном воздействии ДХ на животное в течение 30 суток структура эпителия трахеи оставалась примерно такой же, как в контроле. Существенным отличием было большое количество активированных бокаловидных клеток, некоторые из которых были практически полностью опустошены (см. рисунок, г).
Первоначально в выявленных активированных бокаловидных клетках было повышено содержание муцина – одного из основных компонентов секреции этих клеток. При длительном воздействии ДХ число клеток достигает максимума, однако муцин в них не регистрируются. Это свидетельствует о практически полном их опустошении.
Для оценки состояния клеток эпителия и антиоксидантной системы этих клеток определяли уровень экспрессии маркеров апоптоза (сaspase-3), пролиферации (Ki-67) и основных ферментов-антиоксидантов (каталазы, глутатионпероксидазы 1–8, пероксиредоксинов 1–6, супероксидисмутазы 1–3) (табл.1).
Уровень экспрессии caspase-3 не увеличивался за время действия ДХ, следовательно в эпителии трахеи не происходило гибели клеток путем апоптоза, что согласуется с гистологическими данными. Значительное (более чем в 10 раз) увеличение экспрессии Ki-67 свидетельствует об активации внутриклеточных процессов.
В первые часы после действия ДХ резко увеличивается экспрессия некоторых ферментов-антиоксидантов, что свидетельствует о реакции клеток трахеи на развитие окислительного стресса. Максимальный уровнь экспрессии зафиксирован через 8 ч после действия ДХ. При хроническом воздействии ДХ наблюдается полная адаптация всех систем.
Влияние ДХ на состояние легких
Гистологические исследование не выявило заметных изменений в структуре легких под воздействием ДХ.
Так как одним из показателей наличия окислительного стресса в ткани является уровень МДА, исследовали зависимость количества МДА в ткани легких от продолжительности воздействия ДХ (в отличие от эпителия трахеи, где из-за малого количества материала мы не смогли провести такого исследования). Данные табл. 2 показывают, что достоверных различий по содержанию МДА в легких не было отмечено. По-видимому, это свидетельствует о способности антиоксидантной системы легких нейтрализовать образующиеся в их ткани под действием ДХ активные формы кислорода (АФК). Такое предположение вполне правдоподобно, учитывая данные об экспрессии генов ферментов-антиоксидантов.
Данные об уровне экспрессии генов ферментов-антиоксидантов в ткани легкого после действия ДХ представлены в табл. 3. В отличие от трахеи, в эксперименте уровень экспрессии гена caspase-3 несколько выше по сравнению с контролем, однако это не свидетельствует о сколько-нибудь значительной гибели клеток путем апоптоза в ткани легкого. Увеличение экспрессии Ki-67 (примерно в 5 раз) также свидетельствует об активации внутриклеточных процессов в клетках эпителия легкого, однако оно несколько меньше, чем в трахее. Максимум уровня экспрессии генов Ki-67 наблюдается через сутки после действия ДХ, что значительно позднее, чем в трахее.
Динамика экспрессии генов значимых ферментов-антиоксидантов в ткани легкого несколько отличается от таковой для трахеи как по времени, так и по набору ферментов. Это, по-видимому, связано с различным клеточным составом эпителия трахеи и легкого. Активация экспрессии генов-антиоксидантов по времени в ткани легкого и трахее имеет 2 максимума как по времени, так и по типу фермента-антиоксиданта: первый – через 3 ч, второй – через 3 суток.
Обсуждение
Полученные результаты свидетельствует о том, что в эпителии трахеи и легких существенно повышается уровень АФК. Основную роль в нейтрализации избыточного количества АФК играют пероксиредоксины и супероксиддисмутазы, что согласуется с литературными данными о вкладе этих ферментов в нейтрализацию окислительного стресса в верхних дыхательных путях при острых патологиях [6–8]. Для трахеи максимум активации генов пероксиредоксинов и супероксиддисмутаз происходит через 8 ч после действия ДХ. В это же время достигает максимума активация секреции бокаловидными клетками, то есть в трахее существенно повышается защитный потенциал. Тот факт, что одновременно не разрушаются ткани эпителия, свидетельствует об эффективности антиоксидантной защиты, поскольку именно эти ферменты обеспечивают дополнительную защиту клеток эпителия трахеи от избыточного количества АФК.
То же происходит в ткани легкого при воздействии ДХ. Отсутствие роста перекисного окисления липидов и разрушения структуры ткани свидетельствует об эффективности активации антиоксидантной системы. Поскольку активация экспрессии генов ферментов-антиоксидантов в легких имеет 2 максимума (через 3 ч и через 3 суток), можно сделать вывод, что антиоксидантная защита ткани легкого состоит из 2 этапов: первого, когда антиоксидантная система активируется сразу после воздействия ДХ, и второго, когда необходимо нейтрализовать возможные негативные процессы, связанные с окислительным стрессом.
Суммируя вышесказанное, можно сделать заключение, что во время действия паров ДХ в малых концентрациях антиоксидантные системы верхних дыхательных путей заметно активируются и полностью предотвращают возможные нарушения в функционировании клеток трахеи и бронхов. Это согласуется с данными других исследователей, которые не обнаружили значимых нарушений в организме животных при использовании генераторов ДХ, схожих по своим характеристикам с генератором «Барьерный риф» [9, 10]. Принимая во внимание значительное сходство антиоксидантых систем верхних дыхательных путей крысы и человека [11], полученные результаты могут служить доказательством того, что генератор ДХ безопасен и для человека.
Проведенные исследования показали эффективность генератора ДХ «Барьерный риф» для обеззараживания воздуха в зоне дыхания человека и позволили рекомендовать его для профилактики воздушно-капельных инфекций.
* * *
Экспериментальная часть исследования поддержана грантами РФФИ 17-04-00356 и РФФИ 17-04-500371.



