Антиретровирусную терапию (АРТ) проводили в течение первых 10 лет пандемии ВИЧ-инфекции, применяя первый и единственный в то время антиретровирусный препарат – зидовудин. Использование этого и других, появившихся позже препаратов группы нуклеозидных ингибиторов обратной транскриптазы (НИОТ) позволяло лишь временно улучшить качество жизни пациентов и на несколько лет отсрочить летальный исход заболевания. Ситуация изменилась с середины 1990-х годов, когда после создания новых групп антиретровирусных препаратов, в первую очередь ингибиторов протеазы (ИП) и ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ), появилась возможность использовать схемы терапии, включающие препараты разных групп. Такая АРТ стала называться высокоактивной. В результате применения высокоактивной АРТ ВИЧ-инфекция превратилась хоть и во все еще неизлечимое, но уже не неизбежно смертельное заболевание. Таким образом, АРТ стала фактором, оказывающим решающее влияние на продолжительность жизни больных ВИЧ-инфекцией, а следовательно, на летальность и смертность от этого заболевания. В последующие годы с появлением препаратов с лучшей переносимостью и безопасностью (в том числе ингибиторов интегразы – ИИ и новых ННИОТ), это влияние только усиливалось. Следует отметить, что эффективная АРТ снижает и контагиозность пациента, поэтому она рассматривается и как противоэпидемическое мероприятие [1–4].
По данным зарубежных исследований [5, 6], продолжительность жизни людей с контролируемой антиретровирусными препаратами ВИЧ-инфекцией сопоставима с продолжительностью жизни их ВИЧ-отрицательных ровесников с равными социально-поведенческими характеристиками. В настоящее время количество смертей от тяжелых проявлений ВИЧ-инфекции в мире сократилось на 56% в сравнении с пиковым по смертям 2004 г., однако ранние смерти ВИЧ-позитивных остаются проблемой здравоохранения и связаны чаще всего с поздней диагностикой ВИЧ-инфекции, поздним началом лечения [1, 6]. Кроме того, несмотря на одинаковую продолжительность жизни, регистрируется меньшее число лет, которые люди с ВИЧ живут, не испытывая проблем со здоровьем [6].
Понимание причин смертности, связанной с ВИЧ/СПИДом, имеет решающее значение для мониторинга и оценки качества программ диагностики и лечения ВИЧ-инфекции, поскольку гибель людей, инфицированных ВИЧ, в большинстве случаев является прямым следствием несвоевременного предоставления им АРТ или ее неэффективности [7].
Целью исследования было изучение качества проведения в Российской Федерации АРТ у пациентов, начавших получать ее в 2008–2018 гг.
Материалы и методы
В статье обобщены данные многолетнего специального исследования причин летальных исходов среди инфицированных ВИЧ, проводившегося в 2007–2019 гг. во всех регионах страны по заданию Роспотребнадзора Федеральным научно-методическим Центром по профилактике и борьбе со СПИДом ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора (далее – ФНМЦ ПБ СПИД). В рамках этого исследования был разработан специальный опросник. С течением времени его дополняли новыми актуальными данными о причинах летальных исходов, часто встречающихся в клинической практике, для расшифровки категории «прочие причины летальных исходов». Данные по специально разработанной форме собирали из всех 85 субъектов Российской Федерации. Сбор данных проводили за каждый год отдельно, с 2007 по 2014 г. – ежегодно, за каждый год с 2015 по 2018 гг. – 1 раз в 2 года. Сведения были получены из территориальных центров по профилактике и борьбе со СПИДом или иных уполномоченных медицинских организаций и территориальных управлений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека.
Проанализированы результаты АРТ в России за последние 10 лет. Динамику показателей отслеживали через каждые 5 лет. Были изучены данные за 2008, 2013 и 2018 гг. Качество данных, поступивших из регионов, не было однородным, кроме того, согласно федеральному законодательству, изменялось число субъектов Российской Федерации. В 2008, 2013 и 2018 гг. ответы поступили из всех субъектов Федерации, однако качество предоставленных данных по отдельным регионам не было надлежащим, поскольку не все необходимые для анализа строки были заполнены. В связи с этим из детального анализа данных за 2018 г. были исключены сведения по Москве, Московской, Свердловской и Иркутской областям. Несмотря на неполноту информации по этим регионам, сведения, представленные в статье, достаточно репрезентативны для выявления общих тенденций в причинах летальных исходов при ВИЧ-инфекции в Российской Федерации. Для анализа охвата больных АРТ изучали данные, представленные в форме федерального государственного статистического наблюдения Минздрава России № 61 «Сведения о контингентах больных ВИЧ-инфекцией»1, и персонифицированные данные о случаях ВИЧ-инфекции и летальных исходах среди инфицированных ВИЧ в России, поступающие в ФНМЦ ПБ СПИД в виде оперативных донесений согласно действующим санитарно-эпидемиологическим правилам СП 3.1.5. 2826-10.
Результаты и обсуждение
Для оценки эффективности использования АРТ как мероприятия, влияющего на смертность и летальность от ВИЧ-инфекции, а также ее значимости как профилактического мероприятия анализировали охват АРТ (доля пациентов, получающих АРТ). Причем как фактор, влияющий на смертность и заболеваемость, должен учитываться именно охват лечением всех живых пациентов, а не только лиц, состоящих на диспансерном наблюдении. ЮНЭЙДС при этом рекомендует контролировать охват терапией среди оценочного количества людей, живущих с ВИЧ, включая больных, которые не прошли обследования и не знают о своем диагнозе. ООН поставила перед странами задачу к концу 2020 г. выявить 90% лиц, инфицированных ВИЧ, обеспечить 90% из выявленных (81% от всех инфицированных ВИЧ) доступ к АРТ, а также достичь у 90% получающих АРТ (73% от всех инфицированных ВИЧ) снижения вирусной нагрузки (ВН) ниже «эпидемически значимого» уровня 1000 копий/мл (концепция «90–90–90»). Россия как член ООН также приняла на себя обязательство встать на путь реализации этой концепции. Правда, в качестве исходной цифры, от которой рассчитываются охват лечением и доля пациентов с подавленной ВН, часто декларируется не расчетное число лиц, живущих с ВИЧ (как рекомендуют ООН и ВОЗ), а число зарегистрированных больных ВИЧ-инфекцией, а иногда даже число пациентов, находящихся на диспансерном наблюдении. Показателями, свидетельствующими о качестве проводимой АРТ, являются ее своевременное (раннее) назначение, вирусологическая эффективность (достижение неопределяемой ВН), частота прекращения, наличие перерывов в лечении, назначение оптимальных схем АРТ.
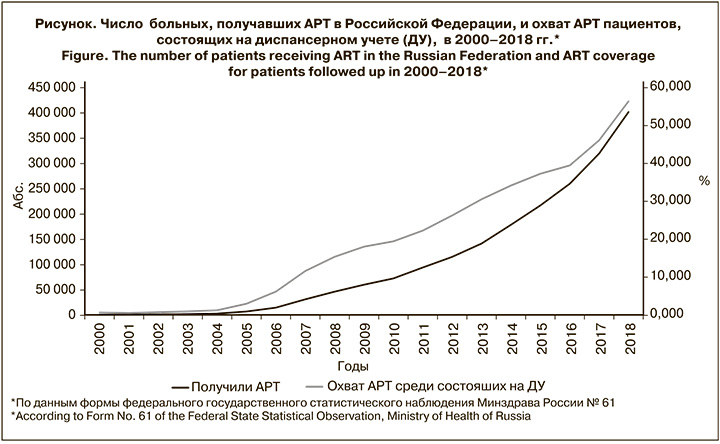
Число пациентов, получающих АРТ, в Российской Федерации в последние годы росло быстрыми темпами: только в 2018 г. АРТ была впервые назначена более чем 120 000 инфицированных ВИЧ, в то время как в 2003 г. АРТ получали лишь 2000 больных. Несмотря на значительное количество новых случаев заражения ВИЧ-инфекцией, происходящих ежегодно, увеличивался и охват лечением. По данным формы № 61, в 2008 г. в Российской Федерации 46 289 пациентов получали АРТ, что составляло 10,9% от числа россиян, живших с диагнозом «ВИЧ-инфекция», и 15,4% от числа состоявших на диспансерном наблюдении. В 2013 г. в стране АРТ получали уже 141 528 человек, охват составил 21,8 и 30,5% соответственно. К 2018 г. этот показатель утроился: всего получали АРТ 401 815 пациентов. По данным формы № 61, охват лечением в Российской Федерации в 2018 г. составил 38,4% от числа живших с диагнозом «ВИЧ-инфекция» и 56,4% от числа состоявших на диспансерном учете (см. рисунок). Необходимо учесть, что данные Минздрава России в последние годы не включают больных, получающих АРТ в местах лишения свободы, что может несколько снижать реальный охват АРТ в стране. Эти данные включены в отчетную форму Роспотребнадзора, и согласно им, в 2018 г. в системе ФСИН АРТ получали 44 319 человек. К концу 2018 г. ВН была подавлена (уровень РНК ВИЧ ниже порога определения) у 294 001 пациентов, что составляло 73,2% от числа получавших АРТ в 2018 г.
Представление о том, насколько своевременно назначается АРТ, можно получить путем анализа данных об уровне иммунодефицита (количестве CD4+-лимфоцитов) у пациентов при начале АРТ (табл. 1).
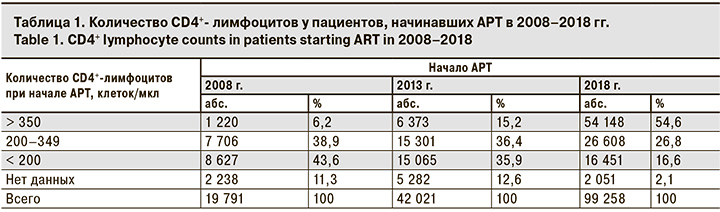
Наблюдается устойчивая тенденция к увеличению доли пациентов, начинающих лечение при более высоком количестве CD4+-лимфоцитов. Вероятно, в первую очередь это связано с изменением рекомендаций по назначению АРТ. В 2008 г. они предполагали назначение АРТ при количестве CD4+-лимфоцитов < 200 клеток/мкл или наличии клинических проявлений вторичных заболеваний2. Обращает на себя внимание тот факт, что среди всех пациентов, начавших АРТ в 2008 г., количество CD4+-лимфоцитов < 200 клеток/мкл было у 43,6%, а среди пациентов с известным уровнем CD4+-лимфоцитов – у 49,1%. Это свидетельствует о наличии у них тяжелого иммунодефицита. Вероятно, многие из них имели вторичные заболевания, как и 11,3% пациентов, у которых сведения о количестве CD4+-лимфоцитов отсутствуют.
В 2013 г. показания к назначению терапии расширились. АРТ предлагалось назначать при количестве CD4+-лимфоцитов < 350 клеток/мкл, клинических проявлениях вторичных заболеваний. Кроме того, приводился список других состояний, при которых рекомендовалось назначать АРТ, в том числе по эпидемиологическим показаниям, для снижения риска передачи ВИЧ неинфицированному партнеру [8]. Следствием этих рекомендаций стало значительное увеличение доли пациентов, начавших АРТ при количестве CD4+-лимфоцитов < 350 клеток/ мкл (с 6,2% в 2008 г. до 15,2% в 2013 г.). Доля пациентов с тяжелым иммудефицитом (< 200 клеток/мкл) в 2013 г. снизилась в 2,8 раза по сравнению с 2008 г., однако доля пациентов, начавших АРТ без данных о количестве CD4+-лимфоцитов, остается высокой.
В 2018 г. назначение АРТ была рекомендована уже всем больным ВИЧ-инфекцией [9], в результате более половины пациентов (54,6%) начали АРТ при количестве CD4+-лимфоцитов > 350 клеток/ мкл, что радикально отличается от данных предыдущих лет. С другой стороны, несмотря на рекомендации «лечить всех», предложенные еще в 2016 г., почти половина пациентов начинает АРТ поздно, при количестве CD4+-лимфоцитов < 350 клеток/ мкл. В 2018 г. удалось минимизировать долю пациентов, у которых уровень CD4+-лимфоцитов при начале АРТ неизвестен. Причины этого требуют дополнительного анализа и могут быть следствием положительных изменений: повышения доступности исследования, улучшения хранения и систематизация информации о пациентах и др. С другой стороны, возможно, это отражает отрицательные тенденции в организации лечения больных ВИЧ-инфекцией, например, отсрочку назначения терапии до получения всех результатов обследования.
Анализ информации о препаратах, составляющих схемы АРТ, показал, что в 2018 г. схемы АРТ, включающие ННИОТ, назначали 68,1% пациентов (в 2013 г. – 40,1%), ИП получали 23,5% (в 2013 г. – 48%), ИИ – 5,3%. В 2013 г. группа ИИ не была выделена. В 2008 г. эти показатели не анализировали (табл. 2).
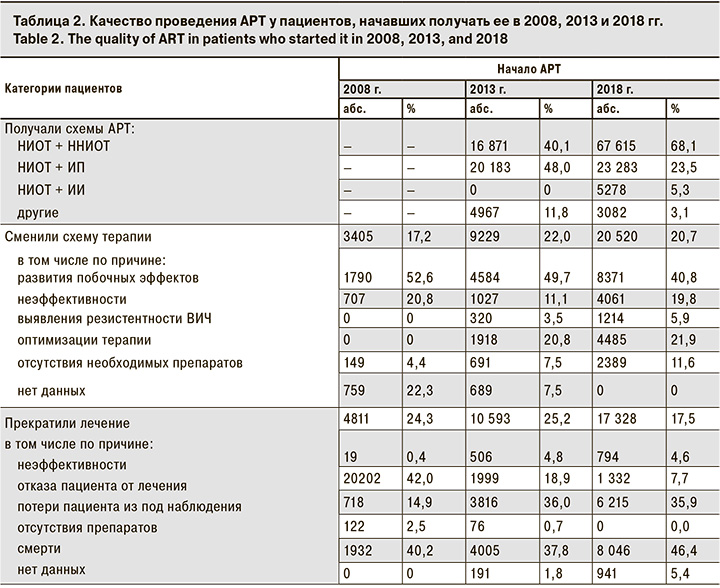
Доля препаратов группы ННИОТ в схемах АРТ с 2013 г. существенно повысилась. ННИОТ, как правило, более дешевы в сравнении с ИП и ИИ, обладают более низким барьером резистентности и худшей переносимостью, особенно в сравнении с ИИ. В 2018 г. доля ННИОТ в схемах лечения была даже выше, чем это предусматривалась стандартом лечения больных ВИЧ-инфекцией 2008 г., в которых им отводилось 63%. К сожалению, более поздние стандарты не позволяют рассчитать частоту назначения отдельных антиретровирусных препаратов и их групп. Стандарт 2012 г. не позволял этого сделать в принципе, а стандарт 2018 г. позволяет рассчитать эти показатели для отдельных групп пациентов, но не для всей популяции в целом. В этом состоит существенный недостаток данных нормативных документов. Такой перекос в сторону препаратов группы ННИОТ, вероятно, сложился в условиях необходимости быстрого увеличения охвата АРТ при ограниченных финансовых ресурсах. Однако долгосрочная экономическая целесообразность такого выбора требует изучения и в настоящее время не оправдана с точки зрения большинства специалистов. Преобладание препаратов с плохой переносимостью и низким барьером резистентности создает угрозу самостоятельного прекращения терапии или пропуска приема препаратов пациентами, повышает риск развития вторичных заболеваний и формирования резистентных к терапии штаммов ВИЧ. Возможно, данная ситуация изменится в связи с выпуском в 2018 г. рекомендаций Национального научного общества инфекционистов, предусматривающих в качестве приоритетной схему АРТ, включающую ИИ с высоким барьером резистентности и благоприятным профилем безопасности [10].
Среди 99 258 пациентов, начавших АРТ в 2018 г., к концу года 17 328 (17,5%) прекратили ее, из них 8 064 (46,4%) – в связи со смертью. В 2008 г. эти показатели составляли 23,3 и 40,2% соответственно, в 2013 г. – 25,2 и 37,8%. Из 8341 живых пациентов, у которых причина прекращения АРТ в 2018 г. была указана, наиболее частой была потеря пациента из под наблюдения – 74,5% (в 2008 г. – 24,9%, в 2013 г. – 59,7%), на 2-м месте (16,0%) – отказ пациента от лечения при сохранении его на диспансерном наблюдении (в 2008 г. – 70,2%, в 2013 г. – 31,2%), В 9,5% случаев указано развитие побочных эффектов (в 2008 и 2013 гг. этот показатель не учитывался). Отсутствие препаратов как причина отмены терапии в 2018 г. не указывалось, но в 2008 г. оно было отмечена у 4,2% пациентов, а в 2013 г. – у 1,2%. Таким образом, отмечается тенденция к уменьшению частоты прекращения АРТ в течение 1-го года лечения. Следует отметить, что в 2018 г. это произошло почти с каждым 5-м пациентом. В 2018 г. не удалось добиться снижения доли прекративших терапию по причине смерти, что в большинстве случаев связано с поздним началом лечения, более того, имеется тревожный тренд на рост этого показателя.
Требует дополнительного изучения и противоположная динамика показателей: нарастание доли потери пациентов из-под наблюдения и снижение доли отказа от лечения. Возможно, это связано с расширением практики снятия с диспансерного учета пациентов, отказавшихся от приема АРТ, в целях достижения целевого показателя 90% охвата АРТ пациентов, находящихся на диспансерном наблюдении, при игнорировании значимости показателя охвата АРТ лиц, живущих с ВИЧ. Обращает на себя внимание то, что существенное число пациентов прекращает АРТ из-за побочных эффектов, что может свидетельствовать как о недостаточности работы, проводимой с пациентом в целях улучшения приверженности лечению, так и о недостаточной квалификации специалистов, проводящих АРТ. Еще одним объяснением может быть недостаточный доступ специалистов ко всему спектру антиретровирусных препаратов (в первую очередь наиболее современных), который обеспечил бы подбор схемы терапии, хорошо переносимой пациентом практически во всех случаях.
Из пациентов, начавших АРТ в 2018 г., к концу года остались на лечении 81 930. Из них 20 520 (20,7%) сменили схему (в 2008 г. таких было 17,2%, в 2013 – 22,0%). Причиной смены терапии у 40,8% больных стало развитие побочных эффектов (в 2008 г. – у 52,6%, в 2013 г. – у 49,7%), у 21,9% – оптимизация терапии (переключение на другую схему в целях предотвращения развития побочных эффектов и улучшения приверженности). В 2013 г. этот показатель составил 20,8% (в 2008 г. его не анализировали). Неэффективность предыдущей схемы в 2018 г. стала причиной ее смены у 19,8% пациентов (в 2008 г. – у 20,8%, в 2013 г. – у 11,1%). Смена терапии по причине отсутствия необходимых препаратов в 2018 г. отмечена у 11,6% пациентов (в 2008 г. – у 4,4%, в 2013 г. – 7,5%). Среди пациентов, сменивших схему АРТ из-за ее неэффективности, только в 29,9% случаев неэффективность терапии была подтверждена результатами исследования на резистентность. В 2008 г. этот показатель не анализировался, а в 2013 г. составил 31,2%. Нарастает частота смены терапии вследствие отсутствия необходимых препаратов, что может отражать негативное влияние изменений в организации закупок антиретровирусных препаратов. Кроме того, в 2018 г. в сравнении с 2013 г. увеличилась доля случаев неэффективности предыдущей терапии как причины смены схемы АРТ. Этот факт может служить отражением нарастания распространенности резистентных штаммов ВИЧ, в том числе за счет широкого применения препаратов с низким барьером резистентности, и низкой эффективности работы по повышению приверженности, которая часто проводится формально. При этом замена неэффективной схемы в большинстве случаев проводилась «вслепую», без проведения теста на резистентность, что повышает вероятность неэффективности и следующей схемы АРТ.
Выводы
Исследование эффективности применения АРТ в России за десятилетний период (2008–2018 гг.) позволило выявить тенденции, оказывающие влияние на заболеваемость и смертность от ВИЧ-инфекции:
Охват АРТ в Российской Федерации существенно увеличился за последние 10 лет, но оставался недостаточным для эффективного снижения показателей смертности и заболеваемости ВИЧ-инфекцией.
Проблема позднего назначения АРТ остается крайне актуальной, несмотря на значительное увеличение доли больных, получающих АРТ до развития выраженного иммунодефицита.
Сохраняется высокая частота прекращения больными приема АРТ и перерывов в лечении, однако отмечается положительная тенденция к уменьшению частоты прерывания АРТ в течение 1-го года лечения.
Неопределяемая ВН достигнута у 73,2% получавших АРТ в 2018 г., что меньше целевого показателя (90%).
Тестирование на резистентность ВИЧ к антиретровирусным препаратам при замене схемы лечения по причине неэффективности проводили лишь в 1/3 случаев.
Целесообразно широко внедрять в клиническую практику рекомендации Национального научного общества инфекционистов, которые предписывают начинать АРТ с использования препаратов с высоким барьером резистентности и хорошей переносимостью, при необходимости своевременно проводить оптимизацию терапии, проводя замену плохо переносимых препаратов.
Недостаточная приверженность лечению и диспансерному наблюдению значительной доли пациентов с ВИЧ требует расширения охвата, а также изменений в подходах к этой работе с учетом поведенческих особенностей уязвимых групп населения.



