В настоящее время ситуация по развитию пандемии COVID-19 в мире и России остается напряженной. На начало января 2022 г. число инфицированных в мире превысило 320 млн чел., а летальных случаев – 5,5 млн. В патогенезе новой коронавирусной инфекции основную роль играет дисрегуляция иммунной системы с избыточным высвобождением цитокинов, конкретный иммунологический механизм которой не совсем ясен [1]. За последний год появилось внушительное количество научных публикаций, в которых авторы пытаются пролить свет на иммунопатологию инфекционного процесса, вызванного SARS-CoV-2.
Интенсивная секреция цитокинов, наблюдаемая у пациентов с COVID-19, особенно при тяжелом течении, является ключевым фактором прогрессирования заболевания и смерти пациентов [2]. Такие пациенты имеют характерный цитокиновый профиль в сыворотке крови, который изучен во многих исследованиях. Рядом авторов было отмечено нарастание уровня воспалительных белков макрофагов (MIP-1A, MIP-1B) у пациентов с тяжелой формой COVID-19. В то же время в этих исследованиях не выявлено достоверного повышения концентрации MIP-1A, MIP-1B у пациентов с бессимптомным и легким течением COVID-19 [3, 4].
MIP принадлежат к семейству хемотаксических цитокинов, известных как хемокины. У людей существуют 2 основные формы – MIP-1А и MIP-1В, которые также называются CCL3 и CCL4 соответственно. Оба являются основными факторами, продуцируемыми макрофагами после их стимуляции микробными компонентами. Они активируют гранулоциты человека (нейтрофилы, эозинофилы и базофилы), что может привести к острому нейтрофильному воспалению, а также индуцируют синтез и высвобождение других провоспалительных цитокинов, таких как IL-1, IL-6 и TNF-a из фибробластов и макрофагов [5]. Выделен ряд молекулярных факторов, таких IL-6, фактор, стимулирующий гранулоциты-макрофаги (GM-CSF) и другие, которые активируют систему моноцитов-макрофагов. Экспрессия IFN I типа и активация тканевых макрофагов усугубляют «цитокиновый шторм», ухудшая сосудистое поражение [4, 5].
Цель работы – определение концентрации MIP-1A, MIP-1B в сыворотке крови у пациентов с тяжелой формой COVID-19.
Материалы и методы
Под наблюдением находились 49 пациентов с тяжелым течением COVID-19, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ) Инфекционной клинической больницы № 2 Департамента здравоохранения города Москвы (ИКБ № 2), в период с 01.04 по 01.09.2020 (основная группа). Группу сравнения составили 30 пациентов со среднетяжелым течением COVID-19, находившихся на лечении в инфекционных отделениях ИКБ № 2 в тот же период.
Критерии включения: возраст от 18 до 90 лет, подтвержденный лабораторно COVID-19, наличие информированного согласия на обработку персональных данных.
Критерии исключения: возраст младше 18 и старше 90 лет, беременность, отсутствие лабораторно подтвержденного COVID-19 у пациента и отсутствие информированного добровольного согласия больного на обработку персональных данных и медицинское вмешательство.
Данная работа представляет собой простое описательное исследование, основанное на анализе клинико-лабораторных параметров больных, включающих данные стандартных лабораторных и инструментальных методов обследования в условиях стационара. Физикальное обследование, оценку жизненных показателей и состояния пациента, пульсоксиметрию с измерением SpО2 проводили в динамике весь период наблюдения.
Диагноз новой коронавирусной инфекции был установлен на основании выявления РНК SARS-CoV-2 методом ПЦР в мазках из носоглотки и ротоглотки (100%). Лабораторный анализ включал, кроме стандартных анализов, исследование уровней воспалительных белков макрофагов (MIP-1A, MIP-1B) в сыворотке крови методом твердофазного ИФА с использованием наборов Bioscience, с автоматической обработкой микропланшетным ридером Anthos 2020 (Anthos Labtec Instruments GmbH, Австрия) при длине волны 450 нм с коррекцией 620 нм с построением стандартной кривой оптической плотности и определением концентрации исследуемых цитокинов согласно инструкциям производителя.
Для статистической обработки результатов использовали программы Microsoft Office Excel 2016 (Microsoft) и библиотеки Matplotlib и Numpy среды программирования Python.
Результаты
Под наблюдением находились 49 пациентов, соответствующих критериям включения, из числа поступивших на лечение в отделение ОРИТ с диагнозом «COVID-19, тяжелое течение».
В основную группу входили 31 мужчина и 18 женщин, средний возраст составил 58,3 ± 12,6 года. Все пациенты поступали в среднем на 8,4 ± 2,3 день болезни (в сроки от 1 до 21 дня). Продолжительность госпитализации в стационаре составила от 1 до 67 дней, в среднем 19,1 ± 10,7 дней.
При поступлении самыми частыми жалобами были лихорадка (81,6%), одышка (77,6%) и сухой кашель (73,5%), диспепсический синдром наблюдался у 2% больных.
Показатели общего и биохимического анализов крови представлены в табл. 1.

У всех пациентов основной группы при поступлении была диагностирована двусторонняя полисегментарная пневмония, однако по данным компьютерной томографии (КТ) органов грудной клетки, КТ 3/4 в момент госпитализации наблюдалась у 16 (32,7%) больных. При поступления в стационар у 42 (85,7%) пациентов уровень SpO2 был ниже 93%. 14 (28,6%) пациентов нуждались в ИВЛ уже в первые сутки госпитализации, на 3–7-е сутки респираторная поддержка потребовалась еще 16 (32,7%) больным.
В группу сравнения были включены 30 пациентов, 12 мужчин и 18 женщин. Средний возраст составил 54,2 ± 9,4 года. Все пациенты поступали в стационар на 3–8-й день болезни, в среднем на 5,2 ± 1,6 день. Продолжительность госпитализации составила от 3 до 8 дней, в среднем 4,7 ± 3,8 дня.
Превышение уровня MIP-1А над пороговым значением отмечено у 42 (84%). пациентов в основной группе и у 3 (10%) – в группе сравнения. Средние концентрации MIP-1А составляли 156,79 и 3,71 пг/мл соответственно, отличие было статистически достоверно (p < 0,01). Концентрация MIP-1А в группах представлена на рис. 1.
MIP-1В детектировался у 48 (96%) пациентов в основной группе и у 11 (36,7%) пациентов в группе сравнения. Средние концентрации MIP-1В составляли 152,62 и 7,53 пг/мл соответственно (рис. 2). Как и в случае с MIP-1А, различие было статистически достоверно (p < 0,01).
У пациентов двух групп наблюдалась статистически достоверная (p < 0,01) корреляция между концентрацией MIP-1a и MIP-1b, коэффициент корреляции Пирсона составлял 0,756. При этом не было отмечено статистически значимых различий, связанных с полом и возрастом. Полученные данные говорят о возможности использования сывороточных концентраций MIP- 1a и MIP-1b в качестве маркеров тяжести заболевания.
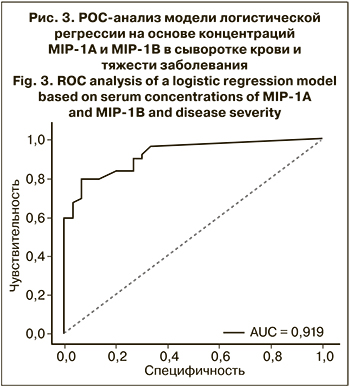
ROC-анализ модели логистической регрессии выявил значимый потенциал MIP-1a и MIP-1b в качестве прогностических маркеров. (рис. 3). AUC (площадь под кривой) оценивается в 0,919, что позволяет предложить MIP-1a и MIP-1b в качестве маркеров тяжести заболевания. Однако следует принимать во внимание относительно небольшой размер выборки.
Обсуждение
Наши результаты частично совпадают с данными других авторов. Так в исследованиях, проведенных в Сингапуре, была отмечена достоверная корреляция уровней MIP-1a и MIP-1b с тяжестью заболевания [6]. Исследования цитокинового профиля 34 пациентов с COVID-19, поступивших в университетскую больницу г. Осло, выявили повышение уровня MIP-1a у пациентов с дыхательной недостаточностью (0,49; р < 0,05), и отрицательную корреляцию между уровнем данного цитокина и отношением PaO2/FiO2. Отмечено, что повышение MIP-1a наблюдалась у пациентов, требующих лечения в ОРИТ [7].
Заключение
Инфекция COVID-19 сопровождается повышением уровня макрофагальных белков воспаления. Тяжелое течение новой коронавирусной инфекции сопровождается более выраженным повышением MIP-1a, MIP-1b в сыворотке крови, что позволяет рассматривать данные показатели в качестве потенциальных маркеров тяжелого течения COVID-19.
Понимание механизмов ускользания SARS-CoV-2 от распознавания иммунной системой, приводящих к отсроченной массивной гиперергической иммунной реакции, позволит идентифицировать мишени для терапии, обозначить факторы прогноза течения и исходов COVID-19, а также будут способствовать разработке эффективных методов лечения.



