Развитие фармацевтической промышленности в последние несколько лет позволило сильно расширить возможности терапии и профилактики вирусных заболеваний [1, 2]. Это связано, в том числе, с разработкой и внедрением новых противовирусных препаратов прямого действия, иммуномодуляторов и вакцин [2]. Однако краеугольным камнем остается своевременная, точная и быстрая лабораторная диагностика. Устойчивое развитие экспериментальной науки способствует расширению спектра используемых методов определения различных микроорганизмов и позволяет перевести некоторые из методик в область рутинной практики диагностических лабораторий [3, 4]. Лабораторная диагностика вирусных инфекций успешно применяет множество методов, которые с учетом детектируемой мишени можно условно разделить на 2 группы [5, 6]. Прямые методы основаны на выявлении компонентов вируса (антигенов, неструктурных белков или нуклеиновой кислоты), опосредованные – на определении реакции организма на присутствие вируса (антитела различных классов). Существует ряд ограничений при использовании тех или иных методов диагностики, связанных как с особенностями патогена, так и с состоянием организма пациента. Наиболее часто используемым и доступным материалом для исследования является кровь. Однако прямые диагностические методы могут быть малоэффективными в случаях, если имеет место локальная репликация вируса, когда зрелые вирионы не попадают в кровоток [7, 8]; элиминация вируса; изменения в структуре компонентов вирионов в результате мутаций [9]; изменение сценария, по которому развивается патогенетический процесс (скрытая форма гепатита В) [10–15]; цитопения или уменьшение числа клеток-мишеней для репликации лимфотропных вирусов [16–22].
Опосредованные методы также имеют ряд ограничений. Например, наличие гипогаммаглобулинемии у пациента может приводить к неэффективной серологической диагностике из-за нарушения синтеза иммуноглобулинов разных классов [18]. С другой стороны, применение внутривенных препаратов иммуноглобулинов, напротив, теоретически может приводить к гипердиагностике. Таким образом, очевидно, что подход к лабораторной диагностике вирусных инфекций должен быть комплексным.
Своевременное выявление вирусной инфекции особенно актуально для пациентов, находящихся в состоянии первичного или вторичного иммунодефицита. К таким пациентам относятся, в первую очередь, ВИЧ-инфицированные, больные онкологического и онкогематологического профиля, реципиенты костного мозга, органов и тканей, и беременные женщины [4, 7, 16–25]. Пациенты с гемобластозами находятся в состоянии иммунодефицита как на фоне течения основного заболевания (угнетения нормального кроветворения), так и за счет проводимой химиотерапии [7, 24]. У них страдают как клеточное, так и гуморальное звено иммунитета, что может приводить к низкому уровню или практически полному отсутствию иммуноглобулинов [24]. Еще одной проблемой лабораторной диагностики является изменение патогенетического процесса вирусной инфекции на фоне массивной цитостатической терапии [8, 10–13, 15].
 Суммируя вышесказанное, можно выделить 3 основные причины ложноотрицательных результатов вирусологического исследования у пациентов с угнетенным иммунитетом: низкая репликативная активность вируса; патогенез инфекции на фоне измененного состояния иммунитета; «негативное окно». Также нельзя забывать о влиянии человеческого фактора, который зачастую нивелируется автоматизацией лабораторных процессов. На сегодняшний день опубликовано много работ, описывающих изменения патогенеза инфекций, вызванных вирусами гепатитов В (ВГВ) и С (ВГС) [8, 10–13, 15]. Одно из них характеризуется транзиторным характером выявления различных компонентов вириона или антител к вирусным белкам в кровотоке. Например, стандартный маркер ВГВ – поверхностный антиген (HBsAg) – может периодически не определяться в крови больных хронической формой инфекции даже в фазе обострения [10, 11, 13]. Проблемой является широкое распространение скрытых форм ВГВ и ВГС [10–12, 15].
Суммируя вышесказанное, можно выделить 3 основные причины ложноотрицательных результатов вирусологического исследования у пациентов с угнетенным иммунитетом: низкая репликативная активность вируса; патогенез инфекции на фоне измененного состояния иммунитета; «негативное окно». Также нельзя забывать о влиянии человеческого фактора, который зачастую нивелируется автоматизацией лабораторных процессов. На сегодняшний день опубликовано много работ, описывающих изменения патогенеза инфекций, вызванных вирусами гепатитов В (ВГВ) и С (ВГС) [8, 10–13, 15]. Одно из них характеризуется транзиторным характером выявления различных компонентов вириона или антител к вирусным белкам в кровотоке. Например, стандартный маркер ВГВ – поверхностный антиген (HBsAg) – может периодически не определяться в крови больных хронической формой инфекции даже в фазе обострения [10, 11, 13]. Проблемой является широкое распространение скрытых форм ВГВ и ВГС [10–12, 15].
Выбор метода диагностики в зависимости от ситуации позволяет уменьшить число ложноотрицательных результатов тестирования. Применение полимеразной цепной реакции (ПЦР) позволяет сократить период «негативного окна»: для ВГВ – до 30 дней от момента инфицирования (HBsAg выявляется на 21 день позже), для ВГС – до 11 дней (антитела к белкам вируса появляются на 42–70 дней позже), для герпесвирусов – до 7–10 дней от момента реактивации (вирусспецифические ДНК определяются в мононуклеарной фракции клеток периферической крови, антитела выявляются на 21–30 дней позже).
Практика гематологического стационара в последние десятилетие показала необходимость увеличения числа используемых лабораторных методов [7, 8, 17, 25]. При подозрении на ВГВ-инфекцию необходимо тестировать кровь пациентов с угнетенным иммунитетом и реципиентов множественных трансфузий не только на HBsAg, но и на ряд дополнительных маркеров, таких как антитела к ядерному антигену (суммарные анти-НВс и/или анти-НВс-IgM), к е-антигену ВГВ (анти-НВе), а также на вирусную ДНК [25]. При диагностике ВГС-инфекции у онкогематологических больных недостаточно определения только суммарных анти-ВГС, необходимы тесты на наличие вирусной РНК, а также измерение её концентрации и определение генотипа вируса. В зависимости от лабораторных показателей корректируется терапия не только вирусной инфекции, но иногда и основного заболевания. Метод ПЦР, в том числе в режиме реального времени, все больше входит в рутинную практику подразделений, занимающихся диагностикой инфекций.
У онкогематологических пациентов часто развиваются инфекционные осложнения. Описаны случаи реактивации герпесвирусов на фоне лечения гемобластозов, после трансплантации аллогенного костного мозга или стволовых гемопоэтических клеток, а также после множественных трансфузий гемокомпонентов [7, 16–22 ]. Герпесвирусы способны вызывать серьезные осложнения, среди которых поражения центральной нервной системы (менингит, менингоэнцефалит) [20, 22], органов желудочно-кишечного тракта (мукозит, эзофагит, энтеропатия, гепатит, гепатоспленомегалия) [7, 21], органов дыхания (бронхиолит, пневмония), посттрансплантационные лимфопролиферативные заболевания. Вирусы способны также спровоцировать реакцию «трансплантат против хозяина» и пр. Характерная особенность лабораторной диагностики герпесвирусов состоит не столько в самой детекции вируса, сколько в определении фазы инфекции.
 Цель исследования – показать необходимость использования метода ПЦР в рутинной вирусологической диагностике парентеральных вирусных гепатитов и герпесвирусов.
Цель исследования – показать необходимость использования метода ПЦР в рутинной вирусологической диагностике парентеральных вирусных гепатитов и герпесвирусов.
Материалы и методы
Лабораторная диагностика парентеральных вирусных гепатитов
Методом ПЦР в реальном времени в образцах крови 997 пациентов, находившихся на разных стадиях лечения заболеваний системы крови в клиниках ФГБУ «Гематологический научный центр» Минздрава России (далее – ГНЦ) с 2013 по 2015 г., определяли наличие ДНК ВГВ и РНК ВГС с помощью диагностических наборов «АмплиСенс® HBV-FL» и «АмплиСенс® HCV-FL» (ООО «ИнтерЛабСервис», Москва). При получении положительного результата определяли вирусную нагрузку с помощью тест-систем «АмплиСенс® HBV-Монитор-FL» и «АмплиСенс® HСV-Монитор-FL» (ООО «ИнтерЛабСервис», Москва) Методом иммуноферментного анализа (ИФА) определяли серологические маркеры ВГВ и ВГС (HBsAg, анти-HCV и расширенный спектр маркеров ВГВ) с помощью наборов реагентов ЗАО «Вектор-Бест» (Новосибирск).
Лабораторная диагностика герпесвирусов
На маркеры активных герпесвирусных инфекций были исследованы образцы периферической крови онкогематологических пациентов (п = 548). У 315 пациентов развились инфекционные осложнения в виде поражений органов дыхания (пневмония, острая дыхательная недостаточность). В этих случаях исследовали бронхоальвеолярную лаважную жидкость (БАЛЖ) одновременно с образцами крови.
Методом ПЦР в мононуклеарах периферической крови, разбавленных плазмой, и БАЛЖ определяли наличие ДНК вируса простого герпеса 1-го (ВПГ-1) и 2-го (ВПГ-2) типов, а также наличие и концентрацию ДНК цитомегаловируса (ЦМВ), вируса Эпштейна-Барр (ВЭБ), вируса герпеса человека 6-го типа (ВГЧ-6) с помощью наборов реагентов «АмплиСенс EBV/CMV/HHV6-скрин-FL» и «АмплиСенс® HSV I,II-FL» (ООО «ИнтерЛабСервис», Москва).
Методом ИФА в сыворотках крови больных определяли иммуноглобулины класса М к ЦМВ (IgM-ЦМВ), ВПГ-1 (IgM-ВПГ-1) и ВПГ-2 (IgM-ВПГ-2) с помощью тест-систем «CMV-IgM-ELISA PKS medac» и «ВектоВПГ-1,2-IgM» (ЗАО «ВекторБест», Новосибирск), а также к вирусному капсидному антигену ВЭБ (IgM-VCA-ВЭБ) и иммуноглобулины класса G к раннему и ядерному антигенам ВЭБ (IgG-EA-ВЭБ и IgG-EBNA-1) с помощью тест-систем «ВектоВЭБ-VCA-IgM», «ВектоВЭБ-EA-IgG» и «ВектоВЭБ-NA-IgG» (ЗАО «ВекторБест», Новосибирск).
Лабораторная диагностика вирусных инфекций у пациентов с сопутствующим диагнозом «гепатит неясной этиологии»
 У пациентов с сопутствующим диагнозом «гепатит неясной этиологии» определяли все вышеперечисленные маркеры парентеральных вирусных гепатитов и герпесвирусов в периферической крови. Дополнительно методом ПЦР у исследовали биоптаты печени (n = 56) на наличие нуклеиновых кислот ВГВ и ВГС, а также герпесвирусов.
У пациентов с сопутствующим диагнозом «гепатит неясной этиологии» определяли все вышеперечисленные маркеры парентеральных вирусных гепатитов и герпесвирусов в периферической крови. Дополнительно методом ПЦР у исследовали биоптаты печени (n = 56) на наличие нуклеиновых кислот ВГВ и ВГС, а также герпесвирусов.
Статистическую обработку полученных данных проводили с помощью компьютерных программ Microsoft Excel (2010) и Statistica 10 (США). Для выявления достоверности различий показателей в сравниваемых группах использовали t-критерий Стьюдента и χ2-критерий Пирсона. Различия оценивались как достоверные при p < 0,05.
Результаты
Парентеральные вирусные гепатиты
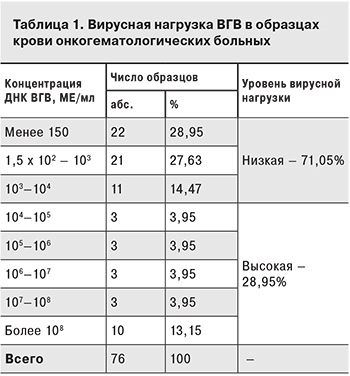
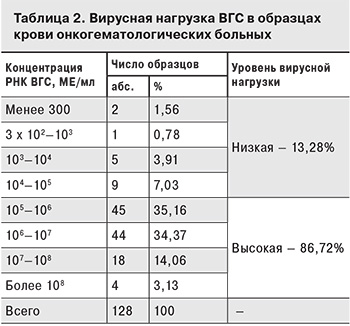
В образцах крови 997 пациентов ДНК ВГВ была выявлена в 76 (7,62%) случаях, РНК ВГС – в 128 (12,84%). Результаты измерения концентрации вирусных нуклеиновых кислот представлены в табл. 1 и 2.
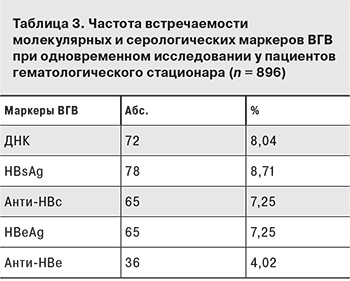
У 930 пациентов исследования на серологические и молекулярные маркеры ВГВ и ВГС были проведены одновременно: у 896 – на маркеры ВГВ, у 843 – на маркеры ВГС. Фактом инфицирования считали выявление любого маркера (кроме изолированных анти-HBs). Так, лабораторные признаки ВГВ-инфекции были выявлены у 187 (20,9%) из 896 пациентов. При этом HBsAg и ДНК ВГВ встречались практически с одинаковой частотой (табл. 3).
У 17 (9,09 %) из 187 инфицированных больных была выявлена ДНК ВГВ при отсутствии HBsAg, при этом у 14 из них концентрация вирусной ДНК не превышала 103 МЕ/мл. У 13 пациентов ДНК ВГВ была единственным маркером. При этом у 11 из них вирусная нагрузка была ниже 103 МЕ/мл.
Серологические и молекулярные маркеры ВГС-инфекции зафиксированы у 130 (15,4%) из 843 пациентов. При этом анти-ВГС выявлены в 124 (14,7%) образцах, а РНК ВГС – в 88 (10,43%). Одновременно оба маркера выявлены в 83 (9,85%) образцах. В 5 образцах РНК была единственным маркеров ВГС, при этом в 2 из них концентрация находилась на грани чувствительности теста (300 МЕ/мл).
Герпесвирусы
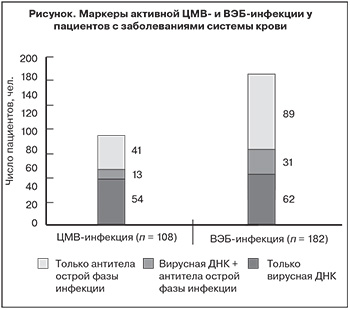
На маркеры герпесвирусов были исследованы 548 образцов периферической крови онкогематологических пациентов, собранных во время развития инфекционных осложнений. Полученные данные представлены на рисунке.
У 182 (33,2%) из 548 пациентов были выявлены маркеры активной ВЭБ-инфекции, а у 108 (19,7%) – маркеры активной ЦМВ-инфекции. Одновременно серологические и молекулярные маркеры активной инфекции выявляли редко: ЦМВ-инфекции – в 12,3% случаев, ВЭБ-инфекции – в 17%.
При обследовании пациентов с пневмонией на фоне химиотерапии гемобластоза (n = 315) герпесвирусные ДНК были обнаружены в 196 (62,2%) образцах БАЛЖ и в 108 (34,3%) образцах крови (р = 0,00001). При этом одновременно в БАЛЖ и периферической крови вирусные геномы выявляются не чаще, чем в 15% случаев.
Гепатиты неясной этиологии
При исследования образцов ткани печени пациентов с криптогенным гепатитом были получены следующие результаты.
 В 20 (35,7%) из 56 биоптатов печени выявлена ДНК ВГВ, а в 14 (25%) – ДНК ВЭБ. В некоторых образцах было обнаружено более 1 вирусспецифической нуклеиновой кислоты: РНК ВГС + ДНК ВГВ – в 2 образцах, ДНК ВЭБ + ДНК ЦМВ – также в 2, ДНК ВГВ и ДНК ВЭБ – в 4 и в 1 образце – ДНК ВГВ + ДНК ВЭБ + ДНК ЦМВ. У 44 пациентов исследование крови и ткани печени на ДНК ВГВ и РНК ВГС было проведено одновременно. У 10 из них ДНК ВГВ была выявлена в биоптатах, но в крови этот маркер обнаружен только у 1 больного. РНК ВГС была зафиксирована в 4 из 44 биоптатов, а в крови – лишь у 2 пациентов.
В 20 (35,7%) из 56 биоптатов печени выявлена ДНК ВГВ, а в 14 (25%) – ДНК ВЭБ. В некоторых образцах было обнаружено более 1 вирусспецифической нуклеиновой кислоты: РНК ВГС + ДНК ВГВ – в 2 образцах, ДНК ВЭБ + ДНК ЦМВ – также в 2, ДНК ВГВ и ДНК ВЭБ – в 4 и в 1 образце – ДНК ВГВ + ДНК ВЭБ + ДНК ЦМВ. У 44 пациентов исследование крови и ткани печени на ДНК ВГВ и РНК ВГС было проведено одновременно. У 10 из них ДНК ВГВ была выявлена в биоптатах, но в крови этот маркер обнаружен только у 1 больного. РНК ВГС была зафиксирована в 4 из 44 биоптатов, а в крови – лишь у 2 пациентов.
Обсуждение
Исследование на маркеры ВГВ и ВГС проводили как при госпитализации больного, так и в случае изменения функции печени (повышение уровней аминотрансфераз и билирубина в биохимическом анализе крови, нарушение белково-синтетической функции печени, гепато-спленомегалия и пр.). Как видно из табл. 1, у большей части (71,05%) пациентов с ДНК ВГВ в крови вирусная нагрузка была низкой, при этом у 28,95% она находилась на пределе чувствительности теста (менее 150 МЕ/мл), что свидетельствует о возможном недовыявлении скрытой формы ВГВ-инфекции. Данный тезис подтверждается сопоставлением результатов ПЦР-исследования на ДНК ВГВ и серологического исследования на расширенный спектр маркеров ВГВ, а также результатами одновременного исследования крови и ткани печени на ДНК ВГВ. У 17 (9,01%) пациентов ДНК ВГВ была выявлена в отсутствие HBsAg, при этом у 14 из них концентрация вирусной ДНК не превышала 103 МЕ/мл. У 13 пациентов вирусная ДНК была единственным маркером, а у 11 из них вирусная нагрузка была ниже 103 МЕ/мл, что дает основания предположить у этих пациентов ранний срок первичного инфицирования ВГВ. Применение ПЦР позволило дополнительно выявить 17 пациентов с ДНК ВГВ в крови и отсутствием HBsAg, который является основной мишенью при диагностике этой инфекции. Также с помощью метода ПЦР были выявлены 13 пациентов предположительно с первичным инфицированием ВГВ, 11 из которых – на ранней стадии в период «негативного окна».
При изучении уровня репликации ВГС получены противоположные результаты. У 111 (86,72%) из 128 пациентов, в крови которых выявлена РНК ВГС, выявлена высокая (более 105 МЕ/мл) вирусная нагрузка. При одновременном исследовании методами ИФА и ПЦР маркеры ВГС-инфекции зафиксированы у 130 из 843 пациентов. При этом анти-ВГС выявлены в 124 (14,71%) образцах, РНК ВГС – в 88 (10,43%), одновременно оба маркера – в 83 (9,84%). Таким образом, применение метода ПЦР позволило дополнительно выявить 5 пациентов с ВГС-инфекцией, 2 из которых предположительно находились на ранней стадии первичной инфекции, о чем свидетельствует низкая (менее 300 МЕ/мл) концентрация вирусной РНК. В данном случае нельзя исключить также наличие скрытой формы гепатита С.
Применение только серологических методов диагностики ограничивает возможности детекции патогенов герпесвирусной природы, что может быть связано с наличием у больного «негативного окна» или диспротеинемии (как следствия развития основного заболевания). Данные комплексного обследования онкогематологических больных на маркеры активных герпесвирусных инфекций подтверждают этот тезис. Исследование образцов периферической крови онкогематологических пациентов, собранных в период развития инфекционных осложнений, показано высокую частоту выявления маркеров активной ВЭБ-инфекции (почти у трети больных) и ЦМВ-инфекции (у четверти больных). Несмотря на столь высокую частоту, одновременное выявление серологических и молекулярных маркеров зафиксировано крайне редко (не более 12,3% от всех положительных сигналов). Полученные данные указывают на взаимодополняемость методов ПЦР и ИФА. Это важно в тех случаях, когда использование одного метода не позволяет получить всей необходимой диагностической информации. Так, например, исследование крови на ДНК ВПГ-1 и ВПГ-2 оказывается малоинформативным, поскольку вирус попадает в кровоток только в случае генерализованного поражения или сепсиса [21]. Помимо высокой чувствительности и практически 100% специфичности, еще одним преимуществом ПЦР является возможность исследования клинического материала непосредственно из очага поражения. Данный тезис подтверждают результаты предыдущего нашего исследования [7].
Поражение печени может быть вызвано не только вирусами гепатитов, но и другими гепатотропными или лимфотропными вирусами. При исследовании 56 образцов ткани печени пациентов с криптогенным гепатитом были выявлены геномы вирусов, для которых описана их ассоциация с клинически выраженным гепатитом. Критерием наличия скрытой ВГВ-инфекции считалось отсутствие в крови HBsAg/ДНК ВГВ (либо низкая – менее 150 МЕ/ мл – концентрация ДНК) при наличии ДНК ВГВ в печени. Наиболее информативным материалом для установления факта инфицирования ВГВ (90% против 10%) и ВГС (50% против 50%), оказался именно биоптат печени (по сравнению с плазмой крови), что коррелирует с литературными данными, трактующими наличие ДНК ВГВ в ткани печени как «золотой стандарт» диагностики скрытой ВГВ-инфекции [8, 10]. Таким образом, применение метода ПЦР позволило более чем у половины пациентов с сопутствующим диагнозом «гепатит неясной этиологии» предположить вирусассоциированное поражение печени.
Применение метода ПЦР оказалось актуальным для идентификации этиологического агента при поражении органов дыхания. В случае вирусассоциированной пневмонии и/или острой дыхательной недостаточности у онкогематологических больных вирусологическое исследование крови часто оказывается малоинформативным [4, 17]. При обследовании 315 пациентов с гемобластозами и пневмонией на фоне химиотерапии вирусспецифические ДНК были обнаружены в 196 (62,2%) образцах БАЛЖ и только в 108 (34,3%) образцах крови (р = 0,00001). Таким образом, при одновременном исследовании у больных с поражениями органов дыхания периферической крови и БАЛЖ на наличие герпесвирусных ДНК частота выявления последних достоверно выше в БАЛЖ.
Важным преимуществом метода ПЦР является возможность исследования практически любого клинического материала. Описано 2 случая успешного применения данного метода для выявления этиологических агентов инфекционного осложнения у больных онкогематологическими заболеваниями вне ремиссии, сопровождающиеся поражением слизистых оболочек желудочно-кишечного тракта [7]. В обоих случаях поражение было ассоциировано с вирусами герпетической группы, хотя при ПЦР-исследовании мононуклеарной фракции клеток крови и аспирата костного мозга не было выявлено вирусспецифических ДНК. Однако в материале из очага воспаления были обнаружены ДНК герпесвирусов. В первом наблюдении вирусное поражение кишечника наблюдалось у молодого пациента с рефрактерной к СНОР-терапии агрессивной Т-клеточной лимфомой. Во втором случае вирусная инфекция развилась у пациентки с длительным течением В-зрелоклеточной лимфомы. В результате длительной цитостатической терапии с использованием ритуксимаба (моноклонального антитела анти-CD20) и, возможно, в связи с лейкемизацией лимфомы у пациентки развился как гуморальный, так и клеточный иммунодефицит. Вирус был обнаружен в биоптате ротоглотки.
Исследование материала непосредственно из очага поражения позволяет идентифицировать этиологический агент, что, в свою очередь, позволяет скорректировать антибиотическую терапию [7]. Успешное применение противовирусных препаратов в обоих случаях подтверждает этот тезис.
Заключение
Анализируя данные литературы и результаты, полученные в ходе исследования, можно сделать вывод, что молекулярные методы диагностики, в частности ПЦР, являются удобным инструментом для выявления скрытых форм вирусных инфекций у больных онкогематологического профиля. Использование ПЦР-тестирования при комплексном исследовании крови и ткани печени больных с диагнозом «криптогенный гепатит», негативных по HBsAg и анти-ВГС, позволило идентифицировать патоген и, следовательно, предположить вирусассоциированное поражение печени. Данные, полученные в ходе исследования, показали, что наиболее информативным клиническим материалом для исследования при поражении печени является биоптат, а не периферическая кровь. При подозрении на вирусассоциированную пневмонию у онкогематологических больных также более предпочтительным и информативным является материал, полученный из очага поражения, то есть БАЛЖ, а не кровь. Похожие результаты получены при исследовании материалов при поражении желудочно-кишечного тракта [7]. Очевидно, что лабораторная диагностика вирусных инфекций должна носить комплексный характер. Следует учитывать взаимодополняющую роль различных методов диагностики. Поиск этиологического агента нужно начинать с пораженного органа. Образование антител, а следовательно, выявление серологических маркеров может значительно отставать от появления молекулярных маркеров, что объясняется как наличием «серонегативного окна», так и патогенезом вирусной инфекции и состоянием пациента.



