Известно, что исход вирусных инфекций может зависеть от фоновых хронических гельминтных инвазий [1−3]. Например, гельминты, вызывающие анемию, способны ограничить репликацию вируса [1]. Клиническое течение и исходы вирусной инфекции модулируются иммуносупрессией, вызванной хроническим гельминтозом [1−3].
Обь-Иртышский речной бассейн Западной Сибири является крупнейшим природным очагом описторхоза, вызванного Opisthorchis felineus. В некоторых районах пораженность населения может достигать 95% [4]. В то же время этот регион характеризуется высоким уровнем заболеваемости клещевым энцефалитом (КЭ). Ранее мы установили, что инфекции, вызванные вирусом КЭ, индуцируют у больного в острый период болезни повышенный уровень лимфоцитов с микроядрами (МЯ) в периферической крови, что может свидетельствовать о цитогенетической нестабильности и иметь существенное значение для развития дисфункции иммунного ответа на возбудитель и риска развития клинически тяжелой очаговой формы болезни и/или ее прогредиентного течения. Известно, что хронический описторхоз (ХО) также сопровождается существенным увеличением уровня лимфоцитов и других типов клеток с хромосомными нарушениями, что может вносить свой вклад в формирование иммунодефицита и повышенного риска развития холангиокарциномы, характерных для этого биогельминтоза [5−7]. При этом оказалось, что уровень и длительность сохранения цитогенетических нарушений зависят от полиморфизма генов ферментов глутатион-S-трансфераз, в частности, от присутствия неактивного варианта гена GSTM1 [8]. Поэтому можно предположить, что оценка показателей цитогенетической нестабильности и полиморфизма генов ферментов глутатион-S-трансфераз у больных КЭ и/или ХО могут служить прогностическими маркерами повышенного риска возникновения дисфункции иммунного ответа, иммунодефицита и развития различных осложнений. По-видимому, риск этих последствий может особенно увеличиваться при длительном сохранении цитогенетически аберрантных лимфоцитов и других типов клеток в реконвалесцентный период, что обосновывает необходимость выявления такой группы больных КЭ и/или ХО.
Цель исследования − изучение длительности сохранения цитогенетической нестабильности, являющейся фактором повышенного риска возникновения дисфункции иммунного ответа в реконвалесцентный период у больных острым КЭ, имеющих фоновый ХО, вызванный Opisthorchis felineus, в зависимости от полиморфизма генов ферментов глутатион-S-трансфераз.
Материалы и методы
В исследование были включены 103 больных лихорадочной формой острого КЭ, имеющих фоновый ХО, вызванный O. felineus (возраст – 44,2 ± 2,2 года) – 1-я группа; 74 больных КЭ без инвазии O. felineus (возраст – 42,7 ± 2,6 года) – 2-я группа; 78 больных ХО (возраст – 43,7 ± 1,7 года) – 3-я группа и 75 здоровых доноров (возраст – 45,1 ± 1,9 года), которые составили контрольную группу. Все участники исследования были сопоставимы по возрасту и полу. Больные КЭ находились на лечении в инфекционных отделениях больниц Ханты-Мансийска, Тюмени и Томска. Диагноз ХО был подтвержден обнаружением яиц O. felineus с применением микроскопии кала (метод Като) или/и желчи. Во всех случаях диагноз КЭ верифицирован методом твердофазного иммуноферментного анализа (ИФА) в случае обнаружения положительных титров сывороточных иммуноглобулинов (Ig) класса M или одновременно IgM и IgG к вирусу КЭ с применением тест-систем АО «Вектор-Бест» (Кольцово, Россия). Для исключения сопутствующей патологии определяли титры IgM и IgG к боррелиям иксодового клещевого боррелиоза в сыворотке крови в день обращения пациента и спустя 21 день от момента заболевания. Здоровые доноры были обследованы для исключения описторхоза с помощью микроскопии желчи, полученной при дуоденальном зондировании. Кроме того, диагноз КЭ и других клещевых инфекций у них был исключен на основании данных эпидемиологического анамнеза и с применением ИФА.
Исследование было одобрено этическим комитетом ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава РФ (протокол № 4308 от 19.10.2015), проводилось в соответствии с правилами «О порядке проведения биомедицинских исследований у человека» (2002) и «Правилами клинической практики в РФ» (Приказ Минздрава РФ № 266 от 19.06.2003). Больные до госпитализации не получали лекарственной терапии, им не проводили рентгенологического обследования. Все пациенты подписали добровольное информированное согласие на участие в исследовании и получения от них биологического материала.
Цитогенетическое обследование проведено с использованием микроядерного анализа в цитокинез-блокированных лимфоцитах периферической крови [6].
Материал для исследования (периферическая кровь) был получен в динамике при госпитализации в стационар, а также спустя 1 нед., 1, 3 и 6 мес. в острый и реконвалесцентный периоды КЭ. У всех обследованных проведено культивирование ФГА-стимулированных двухъядерных цитокинез-блокированных Т-лимфоцитов периферической крови согласно общепринятой методике и рекомендациям [9]. Клетки инкубировали в питательной среде RPMI-1640 (Sigma, США) с добавлением эмбриональной телячьей сыворотки (FBS; Sigma, США). Стимулятором деления клеток служил фитогемагглютинин – 10 мкг/мл («ПанЭко», Россия). Для блокирования цитокинеза в телофазе использовали цитохалазин. Через 72 ч от начала культивирования клетки фиксировали смесью метанола и уксусной кислоты в соотношении 3:1. Окраску проводили по методу Гимзе, после чего анализировали препараты под микроскопом, регистрируя частоту клеток с МЯ, просматривая не менее 1000 бинуклеарных Т-лимфоцитов.
С помощью мультиплексной ПЦР проведен анализ аллелей генов GSTM1 и GSTT1 [10]. Выделение ДНК для ПЦР проводили из ядросодержащих клеток крови. Разделение продуктов амплификации и продуктов рестрикции ампликонов проводили в горизонтальном 3% агарозном геле с применением камеры для горизонтального электрофореза ЕС 12-13 («Биоком», Россия). Знак «+» означает присутствие ПЦР-продуктов, и данный донор может быть либо гетерозиготен [GSTM1 (+/0) и GSTT1(+/0)], либо гомозиготен [GSTM1(+/+) и GSTT1(+/+)] по нормальному активному аллелю. Мутантный генотип GSTM1(0/0) или GSTT1(0/0) означает отсутствие на электрофореграмме фрагмента, и данный индивидуум гомозиготен по делеции, что резко снижает активность фермента.
Статистическую обработку полученных данных осуществляли с использованием пакета статистических программ Statistica v.10. С помощью программы The EH Software Program (Rockefeller University, США) проведен расчет частоты отдельных гаплотипов. Количественные данные проверяли на соответствие нормальному закону распределения с помощью критерия Колмогорова−Смирнова. Для определения статистической значимости различий независимых выборок количественных переменных применяли непараметрический U-критерий Манна–Уитни или t-критерий Стьюдента в случае нормального распределения данных. Кроме того, применялся параметрический критерий Стьюдента для зависимых выборок и непараметрический критерий Вилкоксона для парных сравнений. Различия сравниваемых результатов (X ± m, где X – выборочное среднее арифметическое, m – ошибка среднего арифметического) считались достоверными при уровне значимости p < 0,05.
Результаты
Полученные данные (см. таблицу) свидетельствует о том, что у здоровых доноров частота клеток с МЯ колеблется от 0,26 ± 0,05‰ у носителей генов GSTM1(0)/GSTT1(0), до 0,15 ± 0,06‰ – у носителей генов GSTM1(+)/GSTT1(+) и не имеет статистически значимых различий (p > 0,05). У больных 1–3-й групп уровни лимфоцитов крови с МЯ были существенно выше, чем в контрольной группе (р < 0,01). В 3-й группе больных с неактивными вариантами генов GSTM1(0)/GSTT1(0) по сравнению с контрольной группой число лимфоцитов с МЯ возросло в 5,7 раза (p = 0,007). Кроме того, у таких больных уровень клеток с цитогенетическими нарушениями был значительно выше, чем у больных ХО с активными генами GSTM1(+)/GSTT1(+) (p = 0,012).
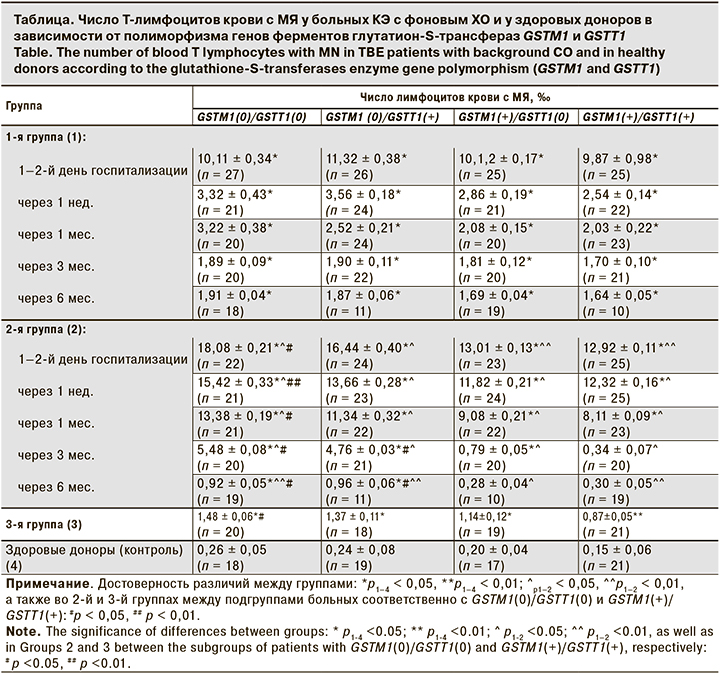
Результаты исследований свидетельствуют о более существенных цитогенетических изменениях у больных 2-й группы по сравнению с больными 1-й группы (р < 0,001). Число клеток с цитогенетическими нарушениями у больных 2-й группы в первые дни болезни и в течение последующих 6 мес. наблюдения в группе носителей неактивных форм гена GSTM1(0)/GSTT1(0) было существенно выше, чем у лиц с генотипом GSTM1(+)/GSTT1(+) (p < 0,01). Изучение уровня лимфоцитов с МЯ в динамике свидетельствует о том, что нормализация этого показателя до значений, сопоставимых с данными у здоровых доноров, через 3–6 мес. после начала КЭ была отмечена только у носителей активных аллелей генов GSTM1(+)/GSTT1(+) (p > 0,05).
Иные закономерности отмечены у больных 1-й группы. У них число лимфоцитов с МЯ повысилась значительно меньше, чем у больных 2-й группы (р<0,001). Так, у носителей неактивных форм гена GSTM1(0)/GSTT1(0) в первые дни болезни число клеток с цитогенетическими нарушениями было значительно снижено по сравнению с соответствующими показателями у больных 2-й группы (р < 0,001). Такая же закономерность наблюдалась и в других подгруппах не только в первые дни болезни, но и через 1 нед., 1 и 3 мес. после начала болезни (во всех случаях p < 0,001). Более того, если через 6 мес. после начала болезни у больных 2-й группы среди носителей гена GSTM1(+)/GSTT1(+) уровень лимфоцитов с цитогенетическими нарушениями был сопоставим с показателями в контрольной группе, то у больных 1-й группы его полной нормализации не произошло. Кроме того, в 1-й группе значимых различий уровней лимфоцитов крови с МЯ у больных с активными и неактивными формами генов не установлено (во всех случаях p > 0,05).
Обсуждение
Ранее нами было показано, что цитогенетические последствия многих инфекций зависят от состояния иммунной системы пациента [11]. Известно, что как описторхоз, так и многие вирусные инфекции, включая КЭ, индуцируют повышенные уровни клеток с цитогенетическими нарушениями, включая увеличение числа клеток с МЯ [5, 11−13]. Данные литературы свидетельствуют о значительной уязвимости системы Т-лимфоцитов при ХО и остром КЭ, что проявляется изменением количественных характеристик субпопуляции этих клеток и продукции цитокинов. Установлено, что ХО вызывает иммунодепрессию и может способствовать развитию холангиокарциномы [4, 6, 7]. Интересно отметить, что цитогенетические нарушения, выявленные в настоящем исследовании, регистрировали в Т-лимфоцитах крови, поскольку фитогемагглютинин, применявшийся для получения культур лимфоцитов, в основном стимулирует именно эту популяцию клеток. Можно предположить, что элиминация субпопуляций Т-клеток за счет апоптоза цитогенетически аберрантных клеток является одной из причин зарегистрированного нами уменьшения числа лимфоцитов с МЯ у больных 1-й группы по сравнению с пациентами 2-й группы, в особенности в острый период болезни.
Вместе с тем выявленное нами длительное (более 6 мес.) сохранение в реконвалесцентный период повышенного уровня лимфоцитов с цитогенетическими нарушениями у больных 1-й группы и у больных 2-й группы с неактивными генами может свидетельствовать о повышенном риске развития дисфункции иммунного ответа, иммунодефицита и различных осложнений, включая прогредиентный КЭ и холангиокарциному, что требует дальнейшего изучения для более точного выделения этих групп риска и обоснования связи между выявленными нами цитогенетическими изменениями и особенностями клинического течения и исходов КЭ.
Выводы
- Полученные данные свидетельствуют о том, что повышенные уровни цитогенетических нарушений у больных КЭ с ХО сохраняются существенно дольше (в течение всего периода наблюдения − 6 мес.), чем у больных КЭ без ХО, и не зависят от полиморфизма генов глутатион-S-трансфераз.
- Выявленные изменения могут свидетельствовать о повышенном риске дисфункции Т-клеточного иммунного ответа, иммунодефицита и развития различных осложнений, включая прогредиентный КЭ и холангиокарциномы у больных КЭ, имеющих ХО, что позволяет выделить этих пациентов в отдельную группу риска.
* * *
Авторы выражают благодарность сотрудникам кафедры инфекционных болезней и эпидемиологии ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России, а также врачам инфекционных отделений медицинских учреждений г. Томска и Тюменской области за помощь в получении биологического материала при проведении настоящего исследования и компетентном обсуждении полученных результатов.
Финансирование
Настоящая работа выполнена при финансовой поддержке гранта РФФИ № 16-44-700149.



