Haemophilus influenzae серотипа b (Hib) является ведущим этиологическим агентом гнойных бактериальных менингитов (ГБМ) неменингококковой этиологии. В эпидемический процесс вовлечены преимущественно дети в возрасте до 5 лет [1–4]. Важной составляющей эпидемиологического надзора является микробиологический мониторинг штаммов, ассоциированных с ГБМ. Мониторинг популяции возбудителей ГБМ является необходимой составляющей наблюдения за эпидемическим процессом, поскольку, с одной стороны, он позволяет в некоторых случаях объяснить неодинаковые показатели заболеваемости, наблюдаемые на разных территориях, с другой – своевременно выявить циркуляцию вновь возникших или импортированных на наблюдаемую территорию штаммов с повышенными вирулентными или резистентными свойствами.
С целью проведения микробиологического мониторинга для ряда патогенных микроорганизмов, в том числе для основных возбудителей ГБМ, применяется метод мультилокусного секвенирования-типирования (МЛСТ) [5, 6]. Результатом применения МЛСТ является установление аллелей определенных фрагментов бактериальных генов, обозначение сиквенс-типа бактерии и выявление генетических связей в бактериальных популяциях, ассоциированных с различными параметрами течения эпидемического процесса на основании определенных сиквенс-типов и/или выявленных клональных комплексов. Результаты МЛСТ, полученные разными исследователями, могут быть объединены с помощью сети Интернет через общедоступные базы данных, в которых предусмотрены разные способы анализа информации [7, 8]. В Центральном НИИ эпидемиологии Роспотребнадзора (далее – ЦНИИЭ) метод МЛСТ используется для основных возбудителей ГБМ с 2000 г. Результаты исследований регулярно публикуются в соответствующих базах данных (научные руководители исследований – канд. мед. наук Г.А. Шипулин, д-р биол. наук, проф. А.Е. Платонов и д-р мед. наук И.С. Королева) [9]. Все данные МЛСТ Hib, циркулирующих на территории России, были получены в ЦНИИЭ в течение трех этапов работы.
На первом этапе было проведено исследование штаммов, полученных при изучении заболеваемости ГБМ детей в Москве в 1999–2001 гг. [2]. Было исследовано 40 штаммов на территории Москвы в период с 1997 по 2002 г., 2 штамма из Екатеринбурга, выделенных в 1986 и 2001 гг., и дополнительно – 6 коллекционных штаммов, выделенных в 1984 г. [10, 11].
На втором этапе были исследованы штаммы и клинические образцы, содержащие ДНК Hib, полученные во время изучения заболеваемости Hib-менингитами в регионах России в период 2005–2008 гг. Исследованы 31 штамм и клинический образец, содержащий ДНК Hib, выделенную из крови или спинномозговой жидкости больных Hib-менингитом, а также 2 штамма, изолированные от больных с сепсисом и пневмонией [12–15].
На третьем этапе было исследовано 12 штаммов и 25 образцов спинномозговой жидкости, содержащих ДНК Hib, от больных Hib-менингитом, госпитализированных в 2007–2009 гг. в клинические инфекционные больницы № 1 и № 2 Департамента здравоохранения города Москвы [13, 16].
Всего на протяжении трех этапов исследований было охарактеризовано 116 штаммов и клинических образцов спинномозговой жидкости, содержащих ДНК Hib, которые были получены, за редким исключением, от детей в возрасте до 5 лет с диагнозом ГБМ. Все результаты МЛСТ российских Hib, а также имеющаяся информация об источнике штамма (клинического образца), годах и территории циркуляции были опубликованы в базе данных http://pubmlst.org/hinfluenzae/, которая на момент написания обзора (ноябрь 2016 г.) содержала информацию о 2625 изолятах H. influenzae (1664 сиквенс-типа), из них 624 изолята имели серотип b (224 сиквенс-типа).
Цель данного обзора – анализ результатов МЛСТ российских Hib, полученных в течение трех этапов работы, и эпидемиологическая характеристика представителей циркулирующих сиквенс-типов и клональных комплексов в сопоставлении с зарубежными для определения дальнейших направлений молекулярно-биологического мониторинга Hib.
 Результаты МЛСТ Hib
Результаты МЛСТ Hib
Аллели и сиквенс-типы. Некоторые аллели и большинство сиквенс-типов, обнаруженных у российских Hib, были найдены впервые: из 19 сиквенс-типов 17 были впервые выявлены в течение трех этапов исследования. Значительное количество впервые найденных аллелей и сиквенс-типов может быть связано c тем, что первая работа E. Meats и соавт. [17], регламентирующая методику проведения МЛСТ H. influenzae, и соответствующие результаты генотипирования зарубежных Hib были опубликованы примерно в одно и то же время с результатами, полученными на первом этапе исследования [10, 11]. На момент окончания первого этапа исследования база данных http://pubmlst.org/hinfluenzae/ содержала 163 изолята H. influenzae, из них 57 принадлежали серотипу b, им соответствовало 14 вариантов сиквенс-типов [10]. Это количество сопоставимо с количеством штаммов, генотипированных на первом этапе исследования: 48 штаммов, которым соответствовало 10 вариантов сиквенс-типов, из которых только 1 (сиквенс-тип ST-6) был найден ранее [10]. На сегодняшний день информация о результатах генотипирования российских Hib составляет около 19% всех полученных результатов МЛСТ Hib, опубликованных в базе данных http://pubmlst.org/hinfluenzae/.
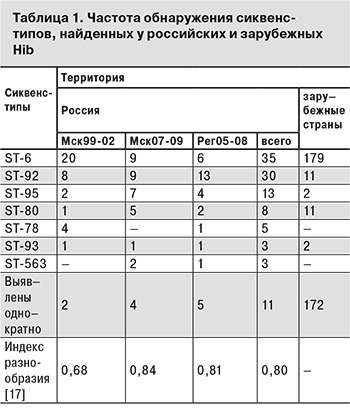
Из всех найденных российских Hib 19 сиквенс-типов 11 были выявлены однократно; преобладали сиквенс-типы ST-6 и ST-92. Индекс разнообразия по Симпсону (численный индекс дискриминации) [18], для всех охарактеризованных Hib равен 0,81, что говорит о достаточной дискриминирующей способности применяемого подхода [17] для характеристики данной бактериальной популяции.
Сопоставление результатов генотипирования российских Hib с изолятами, охарактеризованными за рубежом и представленными в базе данных http://pubmlst.org/hinfluenzae/, представлено в табл. 1, куда включены только сиквенс-типы, выявленные у 3 и более российских Hib, и не включены сиквенс-типы зарубежных Hib, не обнаруженные у российских Hib, а также данные МЛСТ российских Hib, выделенных в 1984 г. Результаты генотипирования российских Hib, полученные в течение трех этапов работы, практически равномерно разделяются на 3 группы в соответствии с периодом времени и территорией, на которой циркулировали возбудители (см. табл.1).
 Группа Мск99-02 объединяет 38 штаммов Hib, выделенных на территории Москвы за 5 лет (1998–2002 гг.). 34 штамма из этой группы были выделены в 2000–2001 гг. Группа Мск07-09 содержит результаты генотипирования 37 штаммов и клинических образцов, содержащих Hib, выделенных на территории Москвы в 2007–2009 гг. В группу Рег05-08 включены результаты генотипирования 33 Hib, циркулирующих вне Москвы на территориях других регионов России преимущественно в 2005–2008 гг.
Группа Мск99-02 объединяет 38 штаммов Hib, выделенных на территории Москвы за 5 лет (1998–2002 гг.). 34 штамма из этой группы были выделены в 2000–2001 гг. Группа Мск07-09 содержит результаты генотипирования 37 штаммов и клинических образцов, содержащих Hib, выделенных на территории Москвы в 2007–2009 гг. В группу Рег05-08 включены результаты генотипирования 33 Hib, циркулирующих вне Москвы на территориях других регионов России преимущественно в 2005–2008 гг.
Таким образом, наиболее характерным для российских Hib является сиквенс-тип ST-6. Преобладание сиквенс-типа ST-92 у Hib, изолированных в регионах России, вероятно, связано с неодинаковым количеством Hib, включенных в исследование. Как для российских, так и для зарубежных территорий характерны циркуляция Hib c сиквенс-типами, выявлемыми однократно (данные не представлены; см. базу данных http://pubmlst.org/hinfluenzae/), и присутствие Hib c сиквенс-типами ST-92, ST-95 и ST-80, которые встречаются с разной частотой и в целом не характерны для Hib, циркулирующих за рубежом.
Клональные комплексы Hib. Ранее с помощью молекулярно-биологических методов типирования было показано, что разные представители бактерий вида H. influenzae по-разному группируются в клональные комплексы. Для представителей всех серотипов H. influenzae, за редким исключением, еще в 1980-е годы была показана клональная структура популяции [19]. Большинство штаммов Hib, выделенных на протяжении нескольких десятков лет в разных регионах мира, распределены по ограниченному количеству клональных комплексов, при этом клональный комплекс A1/A2 объединяет 90% штаммов Hib, изолированных от больных с генерализованной формой инфекции, большинство остальных штаммов входят в клональный комплекс В1 [10, 17, 19, 20].
В табл. 2 представлены результаты классификации всех Hib, содержащихся в базе данных http://pubmlst.org/hinfluenzae/, с помощью метода обработки данных МЛСТ BURST (условием объединения изолятов в группы являлось наличие совпадений по 5 и более локусам в аллельном профиле) [7]. В результате классификации было определено 6 групп и 37 сиквенс-типов, не включенных в группы.
Из обозначенных в табл. 2 шести групп для двух (группы 1 и 2) удается выделить центральный сиквенс-тип, то есть сиквенс-тип, имеющий максимальное число несовпадающих по одному локусу аллельного профиля сиквенс-типов в группе. Этим группам соответствуют клональные комплексы, обозначенные Е. Meats и соавт. как А1/А2 и В1b [17]. Для клонального комплекса А1/А2 центральным сиквенс-типом является ST-6, для клонального комплекса В1b – ST-222. Для клональных комплексов А1/А2 и В1b число сиквенс-типов с отличиями по одному локусу аллельного профиля равнялось соответственно 76 и 15.
Все Hib, циркулирующие на территории России, были включены в группы, соответствующие клональным комплексам. Выделенному нами в предыдущих исследованиях клональному комплексу, образованному сиквенс-типом ST-6, соответствует клональный комплекс А1/А2 (центральный сиквенс-тип ST-6); клональному комплексу, представленному единственным сиквенс-типом ST-93, – клональный комплекс В1b (центральный сиквенс-тип ST-222). Подавляющее большинство российских Hib входило в клональный комплекс А1/А2, характерный для Hib, циркулирующих за рубежом. На особенность российских Hib клонального комплекса В1b указывает присутствие Hib с единственным сиквенс-типом ST-93. Подробное описание и визуализация генетических взаимоотношений российских Hib, принадлежащих клональному комплексу А1/А2, были опубликованы ранее [10, 12].
Использование результатов МЛСТ в эпидемиологическом надзоре и дальнейшие направления молекулярно-биологического мониторинга Hib
Описанное на протяжении нескольких десятилетий ограниченное количество клональных комплексов для инкапсулированных бактерий вида H. influenzae говорит о невысоком уровне рекомбинационных процессов в популяции и, как следствие, относительно низком эпидемическом потенциале данного вида бактерий. Это согласуется с отсутствием данных о масштабных эпидемиях и резких подъемах заболеваемости ГБМ, вызванными Hib: спорадический характер заболеваемости Hib-менингитами характерен для большинства стран, в которых проводили учет заболеваемости Hib-инфекций (исключение могут составлять отдельные вспышки и подъемы заболеваемости в популяциях коренных жителей Америки или Австралии). Распределение российских Hib по клональным комплексам аналогично клональной структуре Hib, циркулирующих на зарубежных территориях. Несмотря на типичное для Hib неравномерное распределение по двум клональным комплексам, некоторые найденные в России сиквенс-типы за рубежом обнаружены не были (см. базу данных http://pubmlst.org/hinfluenzae/). В то же время невысокая частота их выявления не позволяет говорить о существенном вкладе этих бактерий в эпидемический процесс генерализованных форм Hib-инфекции.
Сопоставление данных о заболеваемости Hib-менингитом и результатов МЛСТ его возбудителей позволяет выявить особенности эпидемического процесса, обусловаленного Hib, на разных территориях. Определенная в результате исследования А.Е. Платонова и соавт. [2] заболеваемость Hib-менингитами в Москве составила 5,7 случаев в год на 100 тыс. детей в возрасте до 5 лет. Данное исследование подтвердило многолетние наблюдения специалистов ЦНИИЭ, указывающие на невысокую заболеваемость Hib-менингитами в Москве [21–23] по сравнению со странами Европы и Америки, которая до введения вакцинопрофилактики в той же возрастной группе составляла порядка 10–25 и 20–50 случаев на 100 тыс. соответственно [1, 4, 15, 24]. Более низкую заболеваемость вряд ли можно объяснить циркуляцией на территории Москвы отличных от европейских и американских, менее вирулентных штаммов Hib, поскольку большинство российских Hib входят в клональный комплекс А1/А2, циркуляция представителей которого характерна для территорий Европы и США. Невысокая заболеваемость, скорее всего, связана с социально-биологическими и иммунологическими особенностями населения, определяющими эпидемиологические особенности Hib-менингитов на территории Москвы.
Приведенное в табл. 1 сопоставление результатов МЛСТ Hib, циркулировавших на территории Москвы в 1999–2002 и 2007–2009 гг., также не позволяет говорить о существенных генетических различиях между представителями обеих выборок. Для штаммов, циркулировавших в 2007–2009 гг., характерно меньшее количество Hib с сиквенс-типом ST-6, их отличает бóльшее генетическое разнообразие, описанное в соответствии с P.R. Hunter и соавт. [18], что также выражается в количестве выявленных сиквенс-типов. В то же время, как и в 1999–2002 гг., практически все Hib, циркулировавшие в 2007–2009 гг., входят в клональный комплекс А1/А2 (подробный сравнительный анализ генетических взаимоотношений Hib этих двух выборок приведен нами ранее [16]). Циркуляция Hib, принадлежащих к одному клональному комплексу, согласуется с данными об абсолютном показателе заболеваемости Hib-менингитом в Москве за этот период, который колебался в диапазоне 19–31 случаев в год [2, 3].
Результаты МЛСТ Hib, полученные при изучении заболеваемости Hib-менингитами в 15 регионах России [14], также демонстрируют неравномерное распределение по двум клональным комплексам, что не позволяет говорить об их существенных генетических особенностях. Различия в частоте встречаемости сиквенс-типов у Hib, циркулирующих в регионах, по сравнению с Hib, выявленными в Москве, могут объясняться особенностями изученных выборок: московские штаммы были выделены на одной территории в короткий промежуток времени, в то время как максимальное число штаммов, выделенных на территории одного региона, не превышает 6. Средний показатель заболеваемости Hib-менингитом в регионах России составляет 7,3 на 100 тыс. детей в возрасте до 5 лет в год [14]. Он несильно отличается от показателя заболеваемости в Москве, что также не позволяет говорить о циркуляции на территориях штаммов с повышенными или отличающимися вирулентными свойствами. Различия в эпидемической обстановке, выражающиеся в разных показателях заболеваемости на территориях некоторых регионов России [1, 14, 15], объясняются, по-видимому, иными причинами, не связанными с генотипом возбудителя. Например, Hib, выделенные на территориях с высокой заболеваемостью Hib-менингитами, имеют сиквенс-типы, либо выявляемые на других территориях с более низкой заболеваемостью (сиквенс-тип ST-92), либо не имеющие существенных отличий от уже известных сиквенс-типов клонального комплекса A1/A2 (ST-561 и ST-564). В то же время относительно высокий показатель заболеваемости в некоторых регионах России, который может составлять более 15 на 100 тыс. детей в возрасте до 5 лет, не превышает аналогичных показателей, наблюдавшехся в странах Африки, Америки и северо-запада Европы до введения массовой вакцинации против Hib-инфекции [1, 4, 14, 15].
Неодинаковый уровень заболеваемости Hib-менингитом на различных территориях пока не удается объяснить генетическими различиями циркулирующих возбудителей, определяемыми с помощью МЛСТ. Это может быть связано с ограниченным объемом данных типирования Hib, полученных из регионов с разчным уровнем заболеваемости, а также с недостатком информации о возможной выборочной иммунопрофилактике в этих регионах. Течение эпидемического процесса при Hib-инфекции, предположительно, определяется как особенностями популяционного иммунитета у детей младшего возраста, так и иными, еще не изученными особенностями эпидемического процесса при этой инфекции, не связанными с генетическими особенностями Hib.
Данное наблюдение, с одной стороны, ограничивает роль МЛСТ в эпидемиологическом надзоре за Hib-менингитами в России, с другой – диктует необходимость повышенного внимания к исследованиям параметров эпидемического процесса Hib-инфекции на популяционном и социальном (соцэкосистемном) уровнях [25]. Скорее всего, наблюдаемые мутации в генах, используемых для проведения МЛСТ, не отражают отличий в вирулентности исследуемых штаммов, и эти отличия, по-видимому, следует искать в других фрагментах генома Hib. Перспективным направлением исследований по контролю заболеваемости Hib-инфекцией, возможно, является поиск факторов, определяющих генетическую предрасположенность человека к риску возникновения генерализованных форм Hib-инфекции с целью выявления наиболее предрасположенных лиц. Наличие у людей генетической предрасположенности к развитию генерализованных форм Hib-инфекции косвенно подтверждают сильные различия в уровне заболеваемости, наблюдаемые в разных странах и этнических группах [1, 4, 24].
В связи с этим роль МЛСТ в эпидемиологическом надзоре за Hib-менингитами должна состоять в мониторинге случаев, обусловленных резистентными к антибиотикам штаммами; комплексном анализе заболеваний вакцинированных лиц, а также решении общих задач микробиологического мониторинга возбудителей ГБМ, связанных с проспективным изучением эволюционных процессов, происходящих в популяции возбудителя.



