Вирус герпеса человека 8-го типа (Human herpes virus type 8 – HHV-8) или вирус, ассоциированный с саркомой Капоши, по морфологии, структуре и функциям относят к подсемейству γ-герпесвирусов. Он имеет черты, роднящие его с другими представителями семейства Herpesviridae: сходные структурные элементы, похожую организацию генома, общие механизмы репликации. Тем не менее этот вирус имеет ряд уникальных особенностей, делающих его объектом исследований, актуальных для современной медицины и биологии. HHV-8 – лимфотропный вирус, инфицирует в первую очередь лимфоциты человека и связан с развитием В-клеточных лимфом, саркомы Капоши, ангиоиммунобластной лимфаденопатии, болезни Кастлемана и ряда других лимфопролиферативных заболеваний [1, 2].
По сравнению с другими герпесвирусами HHV-8 менее распространен в человеческой популяции (до 25% случаев) [3]. В то же время инфицированность ННV-8 среди больных саркомой Капоши составляет более 90%, а у здоровых доноров крови антитела к нему выявляются только в 2–9% случаев [4].
У людей с нормальным иммунитетом, инфицированных этим вирусом, в большинстве случаев он клинически никак себя не проявляет. Исследования подтверждают возможность длительной персистенции этого вируса у здоровых лиц и его активации в условиях иммуносупресии. Активация и негативное действие HHV-8 могут проявиться только в случае стойкого снижения иммунитета, например, у ВИЧ-инфицированных больных, особенно в стадии СПИДа. По данным клинических наблюдений, у 45% людей, инфицированных ВИЧ и HHV-8, в течение 10 лет развилась саркома Капоши.
В научных публикациях также описано несколько случаев развития саркомы Капоши и выпотной клеточной лимфомы внутренних полостей тела у пациентов в послеоперационном периоде после трансплантации органов. Поэтому в случаях развития иммуносупрессивных заболеваний, при длительной терапии, снижающей иммунитет (после пересадки органов и тканей, проведении химио- или лучевой терапии) возникает необходимость предварительного обследования доноров и пациентов на иммунный статус в отношении ННV-8 для оценки риска развития саркомы Капоши и других лимфопролиферативных заболеваний.
После открытия в 1994 г. HHV-8 и установления его этиопатогенетической связи с саркомой Капоши были разработаны разные лабораторные технологии для выявления инфицирования HHV-8 [3, 5–10]. В первую очередь это серологические методы выявления антител к антигенам HHV-8, такие как реакция иммунофлюоресценции против литических и латентных антигенов [11–16], иммуноблотинг с различными вирусными белками и иммуноферментный анализ (ИФА) с цельным вирусным лизатом, синтетическими пептидами или с конъюгированными конструкциями рекомбинантных белков и синтетических пептидов [11, 16–20]. Получение вирусной культуры в настоящее время применяют в основном для исследовательских целей, изучения особенностей инфекционного процесса с участием HHV-8 и не используют в практическом здравоохранении для диагностических целей [21].
Известны основные иммунодоминантные белки HHV-8, кодируемые открытыми рамками считывания (open reading frame – ORF), такие как ORF 73 (латентный), ORF 59 (ранний), ORF 65 (мажорный капсидный), ОRF 26 (минорный капсидный) и ORF К8.1 (поверхностный). В серологических тестах (ИФА, иммуноблотинг) показана высокая реактивность латентного (ORF 73) и литического (ORF 65 и К8.1) антигенов с сыворотками крови, полученными от больных СПИДом, ассоциированных с саркомой Капоши. Ранние разработанные ИФА тест-системы не являются диагностически эффективными, поскольку, как показали результаты их научных испытаний, выявляют иммунные антитела в сыворотках крови преимущественно во время острой или активной клинической формы инфекции [22, 23].
Обследование пациентов из групп риска по развитию заболеваний, этиологическим агентом которых является HHV-8 (пациенты со СПИДом, онкологические больные, наркозависимые, пациенты с трансплантацией органов), а также доноров органов и тканей требует использования диагностических тест-систем с более высокими качественными характеристиками. Медицинская лабораторная технология ИФА позволяет быстро проводить скрининг большого количества образцов крови, что необходимо для оперативного выявления лиц с риском развития саркомы Капоши, а также для проведения эпидемиологических исследований на основе выявления серологических маркеров инфицирования HHV-8.
В связи с этим нашей целью была разработка эффективного диагностического набора реагентов для твердофазного ИФА, предназначенного для скрининга образцов сыворотки (плазмы) крови на наличие антител к HHV-8.
Материалы и методы
При конструировании новой тест-системы для твердофазного ИФА по выявлению антител к HHV-8 были использованы:
- разборные полистироловые планшеты для иммунологических реакций с плоским дном лунок (Nunс, Дания, кат. № 446469);
- иммуносорбент – очищенный рекомбинантный антиген HHV-8, содержащий основные иммунодоминантные последовательности белков генома HHV-8, TRX-гибрид (ЗАО «ЭКОлаб», кат. № 41.45);
- конъюгат – моноклональные антитела к IgG человека, связанные с пероксидазой (ЗАО «ЭКОлаб», кат. № 40.06);
- неспецифические реагенты для ИФА производства ЗАО «ЭКОлаб»: субстратно-индикаторный раствор, содержащий хромоген – тетраметилбензидин (кат. № 40.07), 25-кратный концентрат фосфатно-солевого буферного раствора с твином ФСБ-Т (х25) и стоп-раствор 0,5 М серной кислоты.
Проведение ИФА. Очищенный рекомбинантные антиген HHV-8 растворяли в 100 мМ карбонат-бикарбонатном буфере до концентрации 2,5 мкг/ мл (рН 9,6) и вносили по 100 мкл полученного разведения в каждую лунку иммунологического планшета; планшет инкубировали в течение ночи при температуре 4 оC. На следующий день после удаления несвязанного антигена в каждую лунку планшета вносили по 200 мкл блокирующего раствора, «закрывающего» свободные зоны пластика (для предотвращения неспецифической сорбции белков и реагентов на всех этапах проведения ИФА) и выдерживали в течение 30 мин. при комнатной температуре. Затем блокирующий раствор из лунок удаляли, планшет высушивали при температуре 25–27 оС и относительной влажности не более 60% в течение 2,5–3 ч. Планшеты упаковывали в пакеты из алюминиевой фольги на полиэтиленовой основе, запаивали с помощью устройства для вакуумной запайки и хранили до проведения исследования в ИФА.
Для разведения исследуемых образцов сыворотки (плазму) крови и их титрования использовали фосфатный буфер, содержащий в качестве неспецифического сорбента лизат E. coli. Эта бактерия являлась основой при создании производственного штамма (генетического конструкта для получения рекомбинантных белков TRX. На первой стадии ИФА (30 мин. инкубации при 37 оС) антитела, содержащиеся в исследуемых образцах крови, взаимодействовали с рекомбинантным антигеном, иммобилизованным в лунках планшета. После отмывания лунок, во время второй инкубации (30 мин. при 37 оС) антивидовой конъюгат связывался с образованием сложного комплекса: антиген иммуносорбента + антитела исследуемого образца + анти-IgG конъюгата. Наличие такого сложного комплекса выявлялось по цветной реакции с ТМБ-субстратно-индикаторным раствором; при этом интенсивность окрашивания реакционной смеси была прямо пропорциональна концентрации антител к HHV-8 в образце. Результаты ИФА регистрировали с помощью спектрофотометрии, измеряя оптическую плотность реакционного раствора при 450 нм (и/или в двухволновом режиме при длине основной волны 450 нм и референс волне в диапазоне 620–650 нм) и высчитывая индекс позитивности (Ip) по отношению к оптической плотности в лунках с контрольными образцами, не содержащими специфических антител к этому патогену.
Оценку диагностической эффективности нового набора реагентов для ИФА проводили с использованием образцов сыворотки крови, полученных от ВИЧ-инфицированных пациентов, здоровых доноров и пациентов (детей, лиц пожилого возраста), проходивших обследование в диагностическом центре «El Clinic» (ЗАО «Эколаб», г. Электрогорск).
При исследовании образцов сывороток крови были использованы иммуноферментные тест-системы «ИФА-ВПГ-1-IgG», «ИФА-ВПГ-2-IgG», «ИФА-Ветряная оспа-IgG», «ИФА-Эпштейн–Барр-IgG», «ИФА-ЦМВ-IgG», «ИФА-ВГЧ-6-IgG», разработанные и производимые ЗАО «Эколаб».
Для оценки показателей диагностической эффективности новой разработанной ИФА тест-системы в сравнительных испытаниях были использованы наборы реагентов:
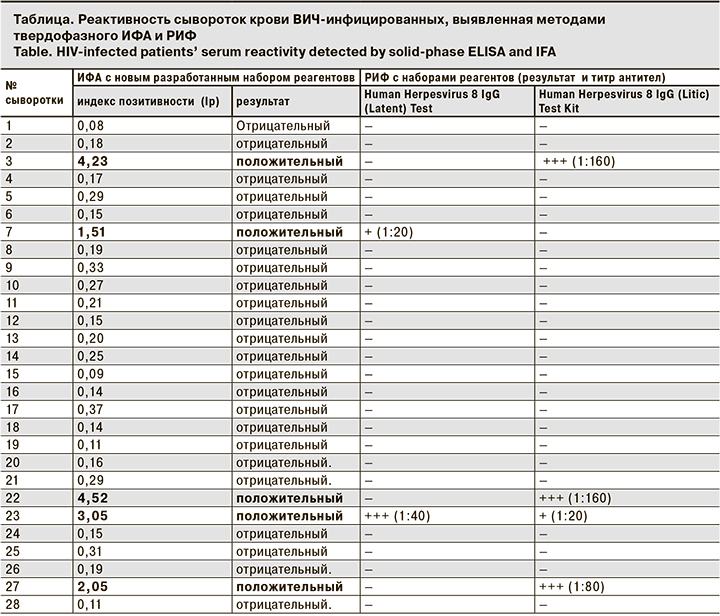
- Human Herpesvirus 8 IgG (Latent) Test Kit, I-HV802G (Scimedx Corporation, США) для выявления IgG к латентному антигену HHV-8;
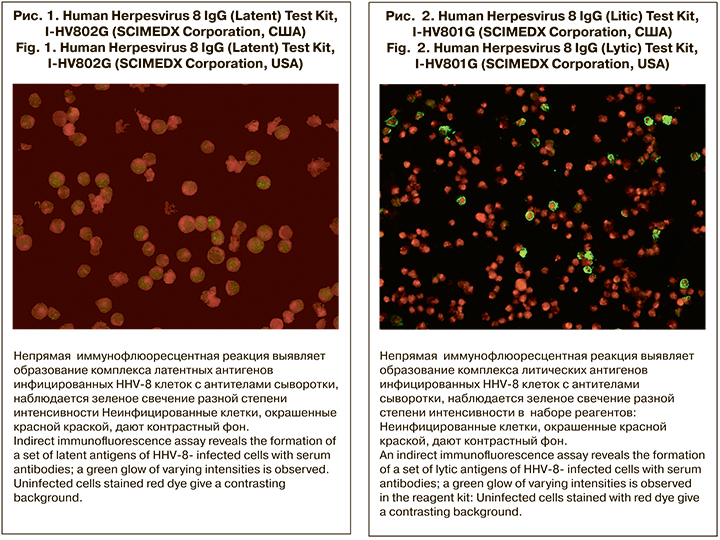
- Human Herpesvirus 8 IgG (Litic) Test Kit, I-HV801G, I-HV803G (Scimedx Corporation, США) для выявления IgG к литическим антигенам HHV-8.
Оба набора предназначены для постановки непрямой реакции иммунофлюоресценции (РИФ). Учет и интерпретацию полученных результатов проводили в соответствии с инструкциями производителя.
Результаты
Вектор действия твердофазного ИФА определяется свойствами иммуносорбента, который должен обеспечить достаточную чувствительность и свести к минимуму неспецифическое взаимодействие с белками исследуемого образца и реагентами на всех этапах анализа. Поэтому при разработке нового набора для ИФА одна из задач была связана с получением иммуносорбента с высокими качественными характеристиками.
На основе изучения научных публикаций был отобран оптимальный состав антигенов HHV-8, характеризующих этот патоген на разных стадиях развития инфекции, и разработана технология его производственного получения в виде ТРХ рекомбинантного гидрида. Были выполнены серии генно-инженерных исследований по созданию нового штамма-продуцента рекомбинантного антигена, содержащего основные иммунодоминантные последовательности белков генома HHV-8 на основе E. coli, его культивированию, выделению и очистке конечного продукта (TRX-гибрид, ЗАО «ЭКОлаб», кат. № 41.45). Осуществлен подбор твердофазного носителя: вида пластика, фирмы производителя, оценки сорбционной емкости и однородности (равномерности распределения гидрофобных участков полистирола). Наилучшие результаты были получены с полистироловыми планшетами производства фирмы Nunс (Дания, кат. № 446469). При получении иммуносорбента необходим подбор оптимальной концентрации белкового реагента, чтобы избежать эффекта десорбции с поверхности полистирола. Для стабилизации сорбированного комплекса и предотвращения неспецифического связывания с полистиролом других белковых структур на всех стадиях ИФА проводится обработка иммуносорбента блокирующими и стабилизирующими растворами. Эти этапы приготовления иммуносорбентов для наборов реагентов разного назначения серологической диагностики нами технологически отработаны. Условия получения нового иммуносорбента для выявления серологических маркеров инфицирования HHV-8 были оптимизированы с неспецифическими реагентами производственного выпуска, используемыми при проведении ИФА различного назначения, такими как отмывающий фосфатно-солевой буферный раствор с твином ФСБ-Т, субстратно-индикаторный раствор, содержащий хромоген, и стоп-раствор 0,5 М серной кислоты.
Результатом проведенных работ явилось создание опытно-экспериментальных серий нового оригинального набора реагентов для выявления серологических маркеров инфицирования человека HHV-8 (условное наименование нового набора – «ИФА-HHV-8-IgG»).
Методом твердофазного ИФА с новым разработанным набором реагентов исследовали 28 образцов сыворотки крови, полученных от ВИЧ-инфицированных лиц (см. таблицу). С 5 (17,85%) из них были получены положительные результаты, свидетельствовавшие о выявлении антител к антигенам HHV-8.
Все образцы дополнительно были исследованы методом РИФ с наборами реагентов для диагностики HHV-8 (Scimedx Corporation, США). Все 5 образцов, выявленные в ИФА с новым набором реагентов, показали положительные результаты и в РИФ: 2 образца сывороток на слайдах в РИФ реагировали с латентными антигенами HHV-8 в титрах 1:20 и 1:40 (рис. 1, см. на вклейке) и 4 образца – с вирусными литическими антигенами (рис. 2, см. на вклейке). Из 4 образцов 3 давали ярко-зеленое флуоресцентное окрашивание в высоких титрах 1:80–1:160 и 1 образец имел слабоположительный результат в титре 1:20; 1 из образцов (№ 23) содержал антитела к обоим видам выявляемых антигенов.
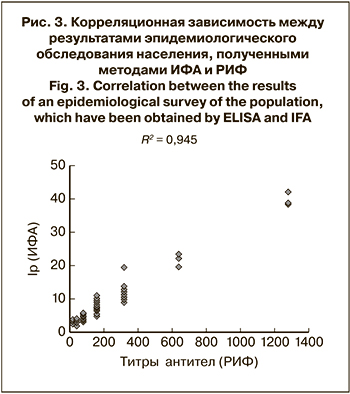
Диагностические возможности нового набора «ИФА-HHV-8-IgG» были использованы для эпидемиологической оценки инфицированности HHV-8 разных групп населения. Испытание 353 сывороток крови, полученных от детей, показало серопозитивные результаты с 3 (0,85%) образцами (возраст детей – 11, 12 и 17 лет). Исследование 744 образцов сывороток крови лиц пожилого возраста (от 60 до 90 лет) выявило присутствие антител к HHV-8 в 98 (13,17%) случаях, причем Ip с 33 (4,44%) образцами был более 5,0. Была показана корреляция между результатами серологического обследования, полученными в ИФА и РИФ (коэффициент корреляции R2 = 0,945) (рис. 3).
 В дальнейшем было исследовано 98 сывороток здоровых доноров крови на содержание антител к ННV-8 методом ИФА с новым набором реагентов. Только 5 (5,10%) образцов были положительны. Известно, что частота выявления антитела к ВЭБ превалируют в человеческой популяции (около 85%), и при наличии перекрестных реакций между специфическими антителами ожидался бы более высокой процент положительных результатов выявления антител к ННV-8.
В дальнейшем было исследовано 98 сывороток здоровых доноров крови на содержание антител к ННV-8 методом ИФА с новым набором реагентов. Только 5 (5,10%) образцов были положительны. Известно, что частота выявления антитела к ВЭБ превалируют в человеческой популяции (около 85%), и при наличии перекрестных реакций между специфическими антителами ожидался бы более высокой процент положительных результатов выявления антител к ННV-8.
Методом ИФА мы изучили возможность проявления перекрестных реакций со стороны антител сыворотки крови, специфичных по отношению к другим герпесвирусам. Для этого среди 150 сывороток крови кадровых доноров крови в ИФА (с тест-системами ЗАО «ЭКОлаб») были отобраны образцы с высоким содержанием антител: к ВПГ-1 (№ 13), ВПГ-2 (№ 6), ВГЧ-3 (№ 10), ВГЧ-6 (№ 9), ЦМВ (№ 9), ВЭБ (№ 11). В РИФ с наборами реагентов для выявления антител к HHV-8 (латентному и литическому антигенам) все образцы показали отрицательные результаты, что демонстрировало отсутствие перекрестных реакций со специфическими антителами к другим герпесвирусам. Чтобы дополнительно подтвердить это положение, сыворотку крови ВИЧ-инфицированного пациента, показавшую в ИФА высокое содержание антител к ННV-8 (1:2000) и к ВЭБ (1:200), подвергли обработке антигеном ВЭБ в разных концентрациях для абсорбции специфических антител (техника «истощения специфических антител»). Затем аликвоты обработанной сыворотки были исследованы в ИФА с наборами «ИФА-Эпштейн–Барр-IgG» и «ИФА-ННV-8-IgG». Оптическая плотность в планшетах с новыми разработанными антигенами ННV-8 для всех образцов не изменилась, а в планшетах из набора «ИФА-Эпштейн-Барр-IgG» показатель оптической плотности в ИФА стал ниже пропорционально остаточной концентрации специфических антител (после абсорбции антигеном). Это исследование дополнительно подтвердило отсутствие перекрестных реакций между специфическими антителами к антигену ВЭБ и антигенами ННV-8 и между антителами к антигенам ННV-8 и антигеном ВЭБ.
Обсуждение
Применение инновационных подходов генной инженерии позволило сделать отбор комплекса сочетающихся между собой латентного и литического антигенов HHV-8, создать технологию промышленного получения нового рекомбинантного антигена HHV-8 и на его основе организовать производство опытно-экспериментальных серий набора реагентов для ИФА («ИФА-HHV-8-IgG»), предназначенного для выявления серологических маркеров инфицирования человека этим вирусом. Использование в новом наборе неспецифических реагентов для ИФА общего назначения (отмывающий фосфатно-солевой буферный раствор с твином ФСБ-Т, субстратно-индикаторный раствор с хромогеном и стоп-раствор) позволит организовать его регулярный производственный выпуск после завершения государственной регистрации «ИФА-HHV-8-IgG» в Российской Федерации в установленном порядке.
Испытание образцов крови, полученных от ВИЧ-инфицированных лиц, показало, что содержание антител к разным антигенам HHV-8 варьирует у разных пациентов и может быть обусловлено сроком инфицирования или активностью самого возбудителя, а также выраженностью иммуносупрессии. Проведение диагностических лабораторных исследований с новым набором для ИФА за счет использования комплексного иммуносорбента (включает латентный и литический антигены) позволяет более эффективно выявлять клинические образцы, содержащие антитела к HHV-8, по сравнению с каждым из испытанных наборов для РИФ по отдельности. Подсчет Ip в ИФА позволяет оценивать относительную напряженность иммунного ответа пациента к антигенам возбудителя, что было продемонстрировано при установлении корреляционной зависимости результатов исследования населения, полученных методами ИФА и РИФ, так как исследования в РИФ большинством специалистов признаются в качестве «золотого стандарта» лабораторной диагностики.
Результаты сравнительных испытаний образцов крови людей с содержанием антител к другим представителям семейства герпесвирусов убедительно продемонстрировали отсутствие перекрестных взаимодействий этих специфических антител с комплексным антигеном новой разработанной тест-системы «ИФА-HHV-8-IgG».
Таким образом, использование в ИФА комплекса латентных и литических антигенов HHV-8 позволяет оценить содержание спектра специфических антител к вирусу и избежать ложноотрицательных результатов.
Эпидемиологический анализ результатов исследования в ИФА показал практическое отсутствие случаев инфицирования HHV-8 детей в возрасте от 1 года до 10 лет, появление отдельных случаев в подростковой группе 11–17 лет (показатель инфицированности в возрастной группе 0–18 лет – 0,85%) и максимальную распространенность этого патогенна среди лиц пожилого возраста (13,17%). У кадровых доноров крови (18–55 лет) показатель частоты выявления антител к HHV-8 имел промежуточное значение – 5,10%. При обследовании группы пациентов с ВИЧ-инфекцией были ожидаемо выявлены более высокие показатели инфицированности HHV-8 (на основании выявления в крови специфических антител) – 17,85%.
Результаты ранее проведенных исследований свидетельствуют о том, что частота выявления различных типов саркомы Капоши в последнее время увеличивается, причем если раньше болезнь чаще развивалась у лиц пожилого возраста, то в последние годы средний возраст больных существенно снизился. Это обусловлено влиянием неблагоприятных социально-экологических факторов, а также частым применением иммуносупрессивной терапии при лечении ряда сопутствующих заболеваний.
Механизм проканцерогенного действия HHV-8 пока еще полностью не изучен.
На ранних этапах заболевания по морфологической картине достаточно сложно проводить дифференциальную диагностику саркомы Капоши с очагами ангиогенеза неопухолевой природы. В этих случаях дополнительным способом верификации диагноза служит исследование биопсийного материала и/или сыворотки крови на присутствие маркеров инфицирования HHV-8.
Заключение
Разработан новый оригинальный набор реагентов «ИФА-HHV-8-IgG», предназначенный для обследования населения с целью выявления инфицированности HHV-8 и оценки риска развития саркомы Капоши и других лимфопролиферативных заболеваний.
Высокие качественные характеристики метода ИФА для выявления антител к HHV-8, отсутствие перекрестных реакций нового разработанного иммуносорбента HHV-8 с другими герпесвирусами, высокая корреляция результатов ИФА с традиционно подтверждающими тестами на основе РИФ позволяют рекомендовать этот лабораторный тест для применения в диагностических целях, для скрининга лиц с повышенным риском развития В-клеточных лимфом, саркомы Капоши, ангиоиммунобластоидной лимфаденопатии, болезни Кастлемана и других лимфопролиферативных заболеваний, а также при сероэпидемиологических исследованиях.



