В довакцинальную эру коклюш был одной из самых распространенных детских инфекций в мире, около 80% случаев заболевания приходилось на долю детей младше 5 лет и лишь менее 3% – на долю подростков, при этом отмечалась высокая смертность среди детей раннего возраста [1]. Вакцины против коклюшной инфекции стали компонентом расширенной программы иммунизации с 1974 г. В результате широкомасштабной вакцинации резко (более чем на 90%) снизились заболеваемость и смертность от коклюша. Однако и на сегодняшний день, по оценкам ВОЗ, коклюш вызывает около 63 000 случаев смерти у детей младше 5 лет [2]. В последнее десятилетие начала меняться эпидемиология коклюшной инфекции. Максимальные показатели заболеваемости сохраняются у детей в возрасте до 1 года, наряду с этим в эпидемическом процессе большую роль играет заболеваемость детей дошкольного и школьного возраста, а также молодых взрослых, ранее привитых, переносящих стертые формы инфекции и являющихся источником инфекции для непривитых детей раннего возраста [3, 4]. В качестве причин создавшейся ситуации рассматривают снижение уровня своевременной привитости; отсутствие иммунитета у привитых через 3–10 лет после вакцинации (известно, что и после инфекции иммунитет может сохраняться от 4 до 20 лет); различие в иммунном ответе, формирующемся при введении бесклеточных и цельноклеточных вакцин; изменение характеристик возбудителя (коклюшной палочки) – появление беспертактиновых штаммов; изменение системы диагностики коклюша: повсеместное введение ПЦР-диагностики [2, 5, 6]. В нашей стране, как и во всем мире, для профилактики коклюша применяют цельноклеточные вакцины, основанные на убитых B. pertussis, и бесклеточные, содержащие отдельные антигены коклюшного микроба (от 1 до 5). Бóльшая безопасность бесклеточных вакцин бесспорна, поэтому с начала ХXI в. в Европе, Америке, Канаде, Австралии, а еще ранее в Японии для профилактики коклюша стали применять именно их [7, 8]. Бесклеточные вакцины эффективны в защите от тяжелых форм коклюша [9], несмотря на меньшую продолжительность создаваемого иммунитета, менее реактогенны, что позволяет применять их у детей с противопоказаниями к вакцинации цельноклеточной коклюшной вакциной, перенесших реакции на цельноклеточную вакцину. И наконец, только бесклеточные вакцины рекомендует ВОЗ для первичной иммунизации и ревакцинаций детей старшего возраста, беременных женщин и взрослых [2, 10]. Бесклеточные вакцины выпускаются как комбинированные препараты, включающие дифтерийный и столбнячный анатоксины, инактивированную полиомиелитную вакцину, вакцину против гемофильной инфекции типа b (пятивалентные) и вакцину против гепатита В (шестивалентные). Применение комбинированных препаратов позволяет уменьшить антигенную нагрузку на организм ребенка (вместо более 3000 антигенов в АКДС 21 – в пятивалентной и 23 – в шестивалентной вакцине [11]), число инъекций, а следовательно, болезненность и стресс при вакцинации, упрощает работу медицинского персонала, экономит средства на необходимом оборудовании для холодовой цепи. В России зарегистрированы и используюантится пяти- и шестикомпонентные препараты: вакцины «Инфанрикс Гекса» – у детей до 36 мес., «Пентаксим» – без возрастных ограничений (в мире данный препарат применяется у детей до 6 лет), а в 2016 г. зарегистрирована бесклеточная коклюшная вакцина с дифтерийным и столбнячным анатоксинами с уменьшенным содержанием антигенов для ревакцинации детей старше 4 лет и взрослых.
Целью исследования явилась оценка реактогенности вакцины «Пентаксим» в рамках пострегистрационного наблюдения при возрастной ревакцинации против коклюша, дифтерии, столбняка, полиомиелита, гемофильной инфекции типа b у детей в возрасте 18 мес. и старше, а также ее безопасности при массовом применении в практическом здравоохранении.
Материалы и методы
Для оценки реактогенности пятикомпонентной вакцины «Пентаксим» на базе отдела профилактики инфекционных заболеваний ФГБУ «Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства» (далее – ФГБУ ДНКЦИБ ФМБА России) проведено клиническое наблюдение за 200 привитыми детьми в возрасте 18–42 мес. (в среднем 19,6 ± 0,06 мес.). Ранее 128 детей были привиты трехкратно вакцинами АКДС + «Имовакс Полио» и 72 ребенка – вакцинами «Инфанрикс» + «Имовакс Полио». У 190 (95%) детей реакций на предшествующую вакцинацию не было, у 10 отмечались обычные общие реакции: у 7 – на АКДС (у 4 – сильные, с температурой 39,6–40,0 оС и у 3 – средней силы), у 3 – слабые реакции на «Инфанрикс». Из 200 привитых 64 (32%) ребенка были практически здоровы, у 136 (68%) в анамнезе отмечены различные заболевания. Среди них выделили 4 группы: дети с аллергическими проявлениями – 49 (24,5% от общего числа привитых) человек; с резидуальными поражениями ЦНС – 46 (23%) человек; часто и/или длительно болеющие (более 4 раз в год с затяжным и осложненным течением) – 26 (13%) человек; с сочетанной патологией – 15 (7,5%) человек. Ревакцинацию вакциной «Пентаксим» проводили через 2–4 недели после выздоровления от острого заболевания или обострения фоновой патологии. Наблюдение за привитыми продолжали в течение 30 дней после вакцинации: детей осматривали ежедневно в первые 3 дня после прививки, на 7-й и 30-й день. Родители вели дневник наблюдения, в который заносили сведения о состоянии ребенка. Оценивали местные проявления (отек, гиперемия, болезненность) и общие реакции (подъем температуры, раздражительность, сонливость, снижение аппетита), а также в течение 30 дней отмечали появление острого заболевания или обострение фонового процесса.
Для оценки безопасности вакцины проведен расчет частоты случаев заболеваний, расцененных как поствакцинальное осложнение, у детей, госпитализированных в ФГБУ ДНКЦИБ ФМБА России, на число доз вакцины, применявшихся в соответствующий период в Санкт-Петербурге.
Статистическую обработку полученных результатов проводили с использованием пакета прикладных программ Microsoft Excel XP по критерию χ2, различия считали достоверными при р < 0,05.
Результаты
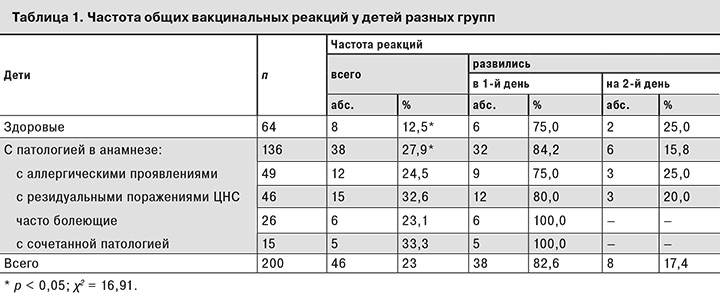
У 154 (77%) детей поствакцинальный период протекал бессимптомно. Общие вакцинальные реакции развились у 46 (23%) детей. Сильная вакцинальная реакция с температурой выше 38,6 оС отмечена у 1 ребенка из группы часто болеющих и у 1 ребенка с поражением ЦНС. У 23 (11,5%) детей развились реакции средней степени с температурой 37,6–38,5 оС. При сильных и средней степени реакциях кратковременно отмечались беспокойство или сонливость, снижение аппетита. У 21 (10,5%) ребенка реакции были слабыми в виде субфебрильной температуры до 37,5 оС без других проявлений. Обычные общие вакцинальные реакции у детей с отягощенным анамнезом возникали достоверно чаще, чем у здоровых (р < 0,05; табл.1). Зависимости между выраженностью вакцинального процесса и принадлежностью к той или иной группе детей с отягощенным анамнезом не выявлено. В большинстве случаев реакции возникали в первый день после прививки. Максимальная выраженность общих реакций (лихорадка) отмечалась в первые сутки, к 4-му дню лихорадка и другие симптомы исчезали. Средние показатели подъема температуры по группам не различалась (табл. 2).
Местные реакции в виде болезненности или отека в месте инъекции, гиперемии отмечены в первые 4 дня у 42 (21,5%) детей. Среди здоровых детей местные реакции развились у 8 (12,5%) человек, что было достоверно реже, чем в группах детей с аллергическими проявлениями (13 человек – 26,5%), поражением ЦНС (12 человек – 26,0%) и часто болеющих (7 человек – 26,9%), но практически не различалось с показателем в группе детей с сочетанной патологией (2 человека – 13,3%) (р < 0,05). Реакции у детей во всех группах, кроме пациентов с аллергиями, возникали в 1–2-е сутки и разрешались к 4-му дню. У детей с аллергическими заболеваниями местные реакции возникли на 2–3-й день и сохранялись в течение 5–7 суток, а размеры гиперемии достигали 37,7 мм. Ни в одной группе не было зарегистрировано поствакцинальных осложнений, в том числе местных (более 80 мм в диаметре).
В течение месяца после прививки у 28 детей были отмечены различные интеркуррентные заболевания: у 21 ребенка – ОРЗ, у 5 – кишечные инфекции, у 1 – паротит и у 1 – перелом плеча. Интеркуррентные заболевания возникли у 4 (6,3%) здоровых детей, у 7 (14,3%) детей с аллергическими заболеваниями, у 6 (13,0%) – с поражением ЦНС (13,0%), у 8 (30,7%) часто болеющих и у 3 (20,0%) детей с сочетанной патологией. Частота интеркуррентных заболеваний у здоровых детей была достоверно меньше, чем в целом у детей с фоновой патологией (р < 0,05; χ2 = 4,67) и чем в группе часто болеющих (р < 0,05; χ2 = 7,07). Интеркуррентные заболевания возникли в 1-й день после вакцинации у 2 детей, на 2-й день – у 2, на 3-й – у 1, на 4-й – у 1, с 5-го про 30-й – у 22 детей. Дифференциально-диагностическим признаком, отличавшим реакцию на вакцинацию от интеркуррентных заболеваний у детей, заболевших в первые 2 дня после вакцинации, помимо лихорадки, было появление катаральных симптомов со стороны верхних дыхательных путей.
Результаты клинического наблюдения подтвердили низкую реактогенность пятивалентной вакцины «Пентаксим» для детей с разным состоянием здоровья.
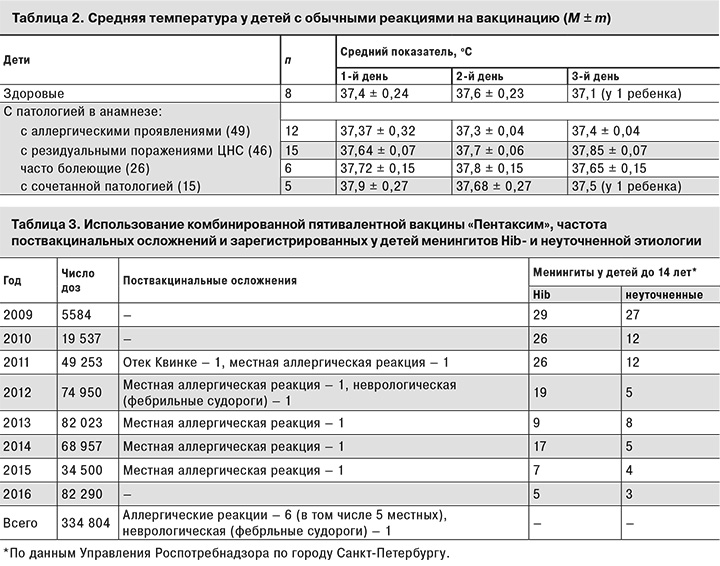
Учитывая широкое применение вакцины «Пентаксим» в Санкт-Петербурге в рамках национального календаря прививок как за счет бюджетов районов, так и на коммерческих условиях по желанию родителей, для оценки ее безопасности проведен расчет соотношения зарегистрированых поствакцинальных осложнений и числа использованных в городе доз вакцины за период 2009–2016 гг. (табл. 3). Диагностику поствакцинальных осложнений проводили в соответствии с методическими указаниями МУ 3.3.1.1123-02 «Мониторинг поствакцинальных осложнений и их профилактика» и МУ 3.3.1879-04 «Расследование поствакцинальных осложнений». Общие аллергические и неврологические осложнения в виде судорог регистрировались с одинаковой частотой: 1 на 334 804 доз вакцины, местные аллергические осложнения – 1 на 66960 доз. Полученные данные подтверждают высокую безопасность комбинированной пятивалентной вакцины.
Других целей в данном исследовании авторы не ставили. Однако учитывая, что вакцина «Пентаксим» включает Hib-компонент, дополнительный интерес представляло сопоставление частоты регистрации менингитов Hib- и неуточненной этиологии с числом примененных доз комбинированной вакцины. За период 2009–2016 гг. число детей раннего возраста, привитых, а следовательно, защищенных от Hib-инфекции, в популяции увеличилось. По данным Управления Роспотребнадзора по городу Санкт-Петербургу, в 2013–2014 гг. почти 40% детей первого года жизни получили прививки комбинированными вакцинами. Нельзя исключить, что это определило тенденцию к снижению у детей числа менингитов как Hib-, так и невыясненной этиологии, среди которых могут быть и Hib-менингиты.
Таким образом, вакцина «Пентаксим» обладает низкой реактогенностью и высоким профилем безопасности, может применяться у детей с разным состоянием здоровья. Наличие в составе вакцины Hib-компонента позволяет реализовать программу профилактики инвазивных форм гемофильной инфекции типа b.



