Боррелиозы – это полиэтиологическая группа спирохетозных инфекций, возбудителями которых являются бактерии рода Borrelia семейства Spirochaetaceae. У человека боррелии вызывают иксодовый клещевой боррелиоз (ИКБ), также называемый лайм-боррелиозом, и возвратный тиф (возвратную лихорадку). Боррелии – возбудители этих двух заболеваний – имеют существенные генетические различия; гомология геномной ДНК составляет от 30 до 44% [1]. Этиологическими агентами ИКБ являются бактерии комплекса Borrelia burgdorferi sensu lato (s.l.), которые, попадая в организм человека при присасывании иксодового клеща, способны вызвать мультисистемное заболевание с широким спектром клинических проявлений [2–4]. Доказано, что возбудителями ИКБ могут быть B. burgdorferi sensu stricto, B. afzelii, B. bavariensis, B. garinii, B. valaisiana, которые широко распространены в зоне умеренного климата Северного полушария и, за исключением B. burgdorferi sensu stricto, встречаются на территории Российской Федерации [5]. Боррелии, вызывающие возвратный тиф, в основном переносятся вшами или аргасовыми клещами [1].
В 1995 г. в Японии в клещах Ixodes persulcatus был обнаружен новый вид боррелий – B. miyamotoi [6], также принадлежащий к группе возбудителей возвратного тифа [7, 8]. Позднее они были найдены в иксодовых клещах, обитающих в Российской Федерации [9–11], европейских странах [12–18] и Северной Америке [19]. Уровень зараженности иксодовых клещей B. miyamotoi варьирует от 1,3 до 15,4% [9, 12, 19, 20].
В 2011 г. опубликованы результаты исследований российских ученых, доказавших способность B. miyamotoi вызывать возвратную лихорадку [21]. Позднее случаи боррелиоза, вызванного B. miyamotoi (БМ), были описаны и другими исследователями [22–26]. При ретроспективном изучении донорской крови в США было установлено, что антитела к маркерам B. miyamotoi (GlpQ-антигену) встречаются приблизительно у 1% людей, причем у больных с диагнозом «лайм-боррелиоз» – в 3,2% случаев, а у лиц, имеющих ассоциированную с присасыванием клеща лихорадку, – в 21% случаев [27]. В некоторых регионах более чем у половины больных безэритемной формой боррелиоза методом ПЦР в крови была выявлена ДНК B. miyamotoi [26].
Случаи заболеваний человека, вызванных B. miyamotoi, в России описаны преимущественно в Европейской части страны и на Урале. Изучение клинических проявлений БМ показало, что в подавляющем большинстве случаев это заболевание протекало с выраженной интоксикацией, без развития эритемы, что существенно затрудняло дифференциальный диагноз с лихорадочной формой клещевого энцефалита [21]. В ходе проспективного изучения клинической картины у 103 больных БМ, госпитализированных в Ижевске в 2010–2014 гг., были установлены поражения внутренних органов: у 25% больных – доброкачественная кардиопатия, у 10% – миокардит, у 60% – синдром цитолиза, у 7% – желтушная форма гепатита, у 10% – признаки быстро купировавшейся почечной недостаточности, у 8% – пневмонии, тогда как хроническая форма БМ не выявлена [2]. Другие авторы [24] указывают на возможность затяжного течения БМ у пациентов, не получавших антибактериальной терапии.
 Особенности клинических проявлений острого БМ и возможность развития хронической формы заболевания в Западно-Сибирском регионе мало изучены. Кроме того, традиционные тест-системы для выявления иммуноглобулинов класса М (IgM) против возбудителей ИКБ не могут быть использованы для диагностики БМ, что вызывает необходимость разработки адекватных методик для включения в комплекс обследования больных на клещевые инфекции.
Особенности клинических проявлений острого БМ и возможность развития хронической формы заболевания в Западно-Сибирском регионе мало изучены. Кроме того, традиционные тест-системы для выявления иммуноглобулинов класса М (IgM) против возбудителей ИКБ не могут быть использованы для диагностики БМ, что вызывает необходимость разработки адекватных методик для включения в комплекс обследования больных на клещевые инфекции.
Цель исследования – верификация диагноза БМ у жителей Новосибирской области и изучение клинических и лабораторных особенностей этого заболевания.
Материалы и методы
В исследование было включено 415 пациентов старше 16 лет, поступивших в Городскую инфекционную клиническую больницу № 1 Новосибирска в период с апреля по сентябрь в 2015 г. (164 человек) и в 2016 г. (255 человек). Критериями включения пациентов в исследование являлись повышение температуры тела более 37 °С, факт присасывания иксодового клеща в срок до 1,5 мес. перед появлением клинических симптомов, добровольное согласие пациента.
Всем пациентам было проведено комплексное клинико-лабораторное обследование. Оценивали клинические симптомы на догоспитальном этапе и в стационаре, на фоне проводимой антибактериальной терапии (доксициклин перорально 100 мг в сутки или цефтриаксон 2 г в сутки внутримышечно в течение от 5 до 10 дней). Исследование гемограммы проводили с помощью анализатора Hemalite («Dixion», Россия), биохимическое исследование крови (АЛТ, АСТ) – с использованием анализатора LABIO 300 («Mindray», КНР).
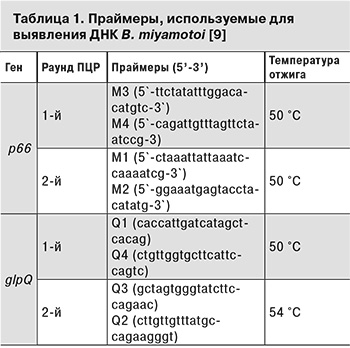
Всем пациентам проводили исследование крови на наличие ДНК B. miyamotoi методом ПЦР. Для этого у каждого больного до начала этиотропного лечения было взято по 5 мл крови с использованием пробирок VACUETTE с ЭДТА. Образцы крови центрифугировали при 500 g в течение 10 мин для получения четкой границы между плазмой и эритроцитарной фракцией крови. Затем плазму крови переносили в отдельную пробирку и центрифугировали при 12 000 g в течение 10 мин для осаждения боррелий. Полученные осадки лизировали в 200 мкл буфера, содержащего 4 М гуанидинтиоционат; 0,1 М Tris-HCl pH 6,4; 0,045 М ЭДТА pH 8,0; 1,3% Тритон X-100 при 65°С в течение 10 мин. Из 100 мкл полученного лизата выделяли ДНК с использованием набора «Проба НК» (ДНК-технология, Россия) согласно инструкции производителя. ДНК B. miyamotoi выявляли методом двухраундовой ПЦР в присутствии видоспецифичных праймеров из области p66 и glpQ B. miyamotoi, как описано ранее (табл.1).
Полученные ПЦР-фрагменты составляли 570 н.п. и 425 н.п. соответственно. Результаты подтверждали секвенированием полученных ПЦР-фрагментов. Для определения нуклеотидных последовательностей полученные продукты ПЦР были очищены с использованием GFX Columns («Amersham Biosciences», USA), нуклеотидные последовательности определяли с использованием генетического анализатора ABI PRISM 3500 («Applied Biosystems», СШA) и анализировали с помощью программы BLASTN (http://www.ncbi.nlm.nih.gov/BLAST).
Нуклеотидные последовательности зарегистрированы в базе данных GenBank под номером KU955521 для фрагмента гена p66 и под номером KX024716 – для фрагмента гена glpQ. Дендрограммы строили методом максимального правдоподобия с помощью программы MEGA 6.06.
Всем больным проводили ИФА для выявления IgM к вирусу клещевого энцефалита с помощью тест-системы ВектоВКЭ-IgM («Вектор-Бест», Россия). В более поздние сроки госпитализации (после 21-го дня болезни) выполняли исследование крови на наличие IgM и IgG к боррелиям комплекса B. burgdorferis.l. c помощью ИФА тест-системы ЛаймБест- IgM («Вектор-Бест», Россия).
Статистическую обработку данных проводили, используя программы Statistica 6.0 и MicrosoftOfficeExcel в операционной среде Windows XP. Определяли доли, средние величины исследуемых морфометрических показателей (М) и среднюю ошибку (m). Достоверность различий определяли с помощью непараметрических критериев Манна–Уитни (U-критерий) и Пирсона (χ2). Различия считали значимыми при р < 0,05.
Результаты и обсуждение
На основании результатов специфических методов исследования (ПЦР и ИФА) из 415 больных БМ был верифицирован у 40 человек и ИКБ – у 74. У всех был исключен диагноз «клещевой энцефалит».
Пациенты были разделены на 3 группы. 1-ю группу составили 40 больных БМ, у которых в крови была выявлена ДНК B. miyamotoi при отсутствии в крови антител к В. burgdorferi в ИФА. Для всех положительных образцов B. miyamotoi были отсеквенированы фрагменты гена p66 длиной 514 н.п. и гена glpQ длиной 359 н.п. Все определенные последовательности фрагментов гена p66 были идентичны друг другу и соответствующим последовательностям азиатского типа B. miyamotoi, ранее обнаруженным в клещах I. persulcatus на территории Новосибирской области и в других регионах России. Все определенные последовательности фрагментов гена glpQ также были идентичны друг другу и соответствовали азиатскому типу B. miyamotoi.
Вo 2-ю группу были включены 64 больных с эритемной формой ИКБ, диагностированной на основании клинико-эпидемиологических данных. У 8 из них диагноз был также подтвержден выявлением антител класса IgM и/или IgG к боррелиям в более поздние сроки.
В 3-ю группу были включены 14 пациентов с безэритемной формой ИКБ. У 11 из них диагноз подтвержден выявлениям специфических IgM в крови.
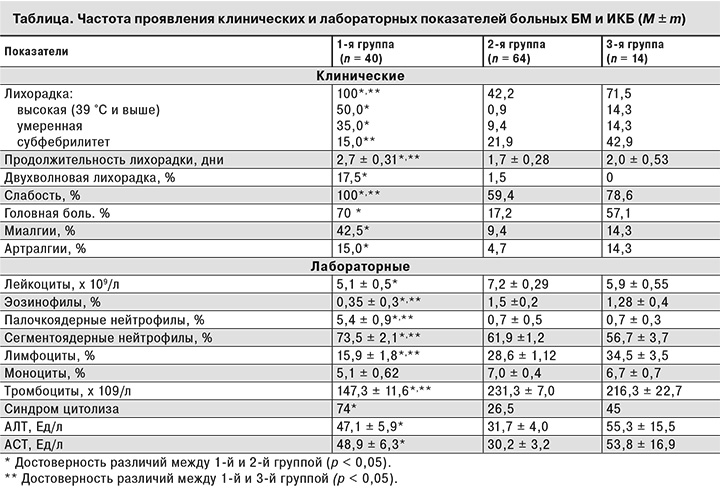
Возраст больных в 1-й группе колебался от 22 до 83 лет (в среднем 51,5 ± 3,3 года), во 2-й – от 16 до 77 лет (в среднем 44,1 ± 5,1 года), в 3-й – от 17 до 87 лет (в среднем 58,5 ± 2,2 года). В 1-й группе преобладали мужчины (62,5%), во 2-й и 3-й они составляли 50 и 35,7% соответственно. У всех пациентов накануне заболевания отмечались присасывания клещей на территории Новосибирской области. Продолжительность инкубационного периода у больных 1-й группы варьировала от 7 до 38 дней, составив в среднем 16,1 ± 1,6 дня, что было сопоставимо с аналогичным показателем у больных 2-й группы (13,6 ± 7,8 дня), но больше, чем в 3-й группе (8,5 ± 1,6 дня) (р < 0,05).
Заболевание у всех пациентов 1-й группы начиналось остро с повышения температуры тела, лихорадка регистрировалась чаще, чем у пациентов других групп (табл. 2). У большинства больных БМ она чаще была высокой (59%) или умеренной (35%), в отличие от больных 2-й группы (р < 0,05), и достоверно не отличалась от показателей больных 3-й группы. Длительность лихорадочного периода в 1-й группе колебалась от 2 до 10 дней и продолжалась больше, чем во 2-й и 3-й группах (р < 0,05). Двухволновая лихорадка наблюдалась у 17,5% больных БМ и не регистрировалась при ИКБ. Вторая волна повышения температуры у больных 1-й группы возникала после 2–3 дней апирексии и характеризовалась кратковременным субфебрилитетом.
Наряду с лихорадкой у большинства пациентов 1-й группы были выявлены проявления интоксикации. Все пациенты отмечали слабость, 70% – головную боль, реже выявлялись миалгии и артралгии. Симптомы интоксикации в 1-й группе регистрировали чаще, чем во 2-й (p < 0,05), тогда как в 3-й группе больные реже отмечали слабость, чем в 1-й (p < 0,05).
Неврологических проявлений в 1-й группе не было зарегистрировано, тогда как в 3-й группе у 1 больного имел место синдром Банноварта.
В гемограмме у 60% больных 1-й группы отмечали нормальное количество лейкоцитов, у 25% больных – лейкопению, у 15% – лейкоцитоз. Средние показатели относительного содержания палочкоядерных и сегментоядерных лейкоцитов у больных 1-й группы были выше, а лимфоцитов и тромобцитов – ниже, чем у больных 2-й и 3-й групп (р < 0,05), (см. табл. 2). Повышение активности трансаминаз выявлено у 74% больных 1-й группы – чаще, чем у больных 2-й группы. Повышение активности АЛТ и АСТ было слабо выражено, средние показатели активности трансаминаз были выше, чем во 2-й группе (p < 0,05) и сопоставимы с показателями пациентов 3-й группы.
Выводы
- У лиц, заболевших после присасываня клеща, произошедшего на территории Новосибирской области в эпидемические сезоны 2015 и 2016 гг., выявлено присутствие в крови ДНК B. miyamotoi азиатского типа. Это является основанием для включения в комплекс методик обследования на клещевые инфекции тест-системы для выявления B. miyamotoi.
- Основным клиническим проявлением инфекции, вызванной B. miyamotoi, была лихорадка, чаще высокая или умеренная, которая не сопровождалась развитием мигрирующей эритемы и неврологических симптомов. У 17,5% больных лихорадка имела двухволновое течение.
- В гемограмме этих больных чаще регистрировали нормоцитоз, нейтрофилез, палочкоядерный сдвиг влево, у 25% больных – лейкопению, у 74% – слабо выраженное повышение уровней трансаминаз.
* * *
Работа выполнена при поддержке Минобрнауки России, проект VI.55.1.1 «Геномика бактериальных и вирусных сообществ».



