Хронический гепатит С (ХГС) – одно из наиболее часто встречающихся сопутствующих заболеваний при ВИЧ-инфекции. По данным ВОЗ, не менее 2,8 млн людей, живущих с ВИЧ (ЛЖВ), страдают ХГС, 90% из них – потребители наркотиков [1]. В России 30–60% ВИЧ-инфицированных поражены ХГС [2, 3]. На фоне успешного лечения ВИЧ-инфекции антиретровирусными препаратами, увеличения продолжительности жизни больных, ХГС и его последствия утяжеляют течение ВИЧ-инфекции и являются одной из основных причин смерти ЛЖВ [3, 4]. Учитывая более высокий риск формирования фиброза у больных с ко-инфекцией ВИЧ/ВГС, современные клинические рекомендации и руководства по лечению ХГС [3, 5–8] относят больных ВИЧ-инфекцией к приоритетным группам для лечения патологии печени.
ВИЧ-инфекция и ХГС, имеющие высокую социальную значимость, наносят весомый экономический ущерб бюджету Российской Федерации [9–11]. С учетом стратегии ВОЗ по эрадикации ХГС к 2030 г. лечение этого заболевания признается необходимой профилактической мерой, ведущей к значительному сокращению источников инфекции [1, 12–15].
Несмотря на то что «золотым стандартом» лечения ХГС являются препараты прямого противовирусного действия (ПППД) [2, 6–8, 16–18], есть данные о выявлении мутаций резистентности к ПППД в 5% случаев [19]. Учитывая проблемы с доступностью ПППД для больных ВИЧ-инфекцией из-за недостаточного финансирования, терапия ХГС с использованием ИФН у ВИЧ-инфицированных до настоящего времени в России актуальна: эффективность лечения этими препаратами достигает 75–80% [3, 20–22].
Цель исследования – ретроспективный анализ результатов лечения ХГС у ВИЧ-инфицированных в зависимости от применения различных схем противовирусных препаратов.
Материалы и методы
В Нижегородской области подтвержденный молекулярно-биологическими методами диагноз ХГС имеют 7596 больных ВИЧ-инфекцией, что составляет 44,6% от числа ВИЧ-инфицированных, состоящих под диспансерным наблюдением. Противовирусная терапия ХГС у больных ВИЧ-инфекцией применяется в Нижегородской области с 2007 г. За это время пролечено 1968 больных или 25,9% от числа нуждающихся в нем. Схемы, включающие Пег-ИФН и рибавирин, получили 1568 (79,7%) больных. Эффективность лечения в зависимости от генотипа вируса составила 72–88%. ПППД получили 20,3% от числа пролеченных больных.
Проведено ретроспективное исследование 388 амбулаторных карт пациентов с ко-инфицией ВИЧ/ ВГС, получавших противовирусную терапию ХГС в Нижегородском областном центре по профилактике и борьбе со СПИД и инфекционными заболеваниями с 2018 по 2022 г. Включенные в исследование пациенты находились под диспансерным наблюдением, получали эффективную антиретровирусную терапию (АРТ) не менее 12 нед. (РНК ВИЧ ≤ 58 копий/мл). Схемы АРТ были стандартными: 2 НИОТ + 1 ННИОТ, или ИП бустированный, или ИИ.
Схемы противовирусной терапии ХГС составлялись в соответствии с действующими клиническими рекомендациями [6–8, 23].
Включенные в исследование пациенты были распределены в 5 групп в зависимости от генотипа вируса и назначенной схемы лечения:
1-я группа (п = 103) – генотип 1, ПегИФН-альфа 2а + рибавирин 48 нед.;
2-я группа (п = 60) – генотип 1, ПегИФН-альфа 2а + рибавирин + нарлапревир + ритонавир 24 нед.;
3-я группа (п = 99) – генотип 1, ПППД 8–12 нед.;
4-я группа (п = 116) – генотип 3, ПегИФН-альфа 2а + рибавирин 24 нед.;
5-я группа (п = 50) – генотип 3, ПППД 8–12 нед.
В группу ПППД для лечения больных с ВГС генотипа 1 входили дасабувир + омбитасвир + паритапревир + ритонавир, нарлапревир + даклатасвир + ритонавир и нарлапревир + софосбувир + ритонавир; с ВГС генотипов 1 и 3 – пангенотипные комбинации велпатасвир + софосбувир, глекапревир + пибрентасвир, гразопревир + элбасвир, даклатасвир + софосбувир.
При этом в 3-ю группу включили 39 больных для «перелечивания» после неэффективного курса терапии ПегИФН, в 5-ю группу – 1 больной для «перелечивания».
Пациенты были стратифицированы по полу, возрасту, пути инфицирования ВИЧ, стадии ВИЧ-инфекции, генотипу ВГС, ВИЧ-ассоциированным заболеваниям, сопутствующим заболеваниям.
У всех пациентов исследовали показатели вирусной нагрузки (ВН) ВИЧ и ВГС, определяли количество субпопуляции лимфоцитов, генотип ВГС, клинический и биохимический анализы крови. Проводили также УЗИ органов брюшной полости и фиброэластометрию.
Эффективность терапии оценивали в соответствии с рекомендациями по лечению ХГС [6–8, 23]: ежемесячно изучали жалобы, объективный статус, нежелательные явления (НЯ); на 4-й (быстрый вирусологический ответ – БВО), 12-й (ранний вирусологический ответ – РВО), 24-й (устойчивый вирусологический ответ – УВО) неделе (у больных с генотипом 3 при лечении ПегИФН и у больных с генотипом 1 при лечении ПегИФН и нарлапревиром), а также на 48-й неделе (у больных с генотипом 1 при лечении ПегИФН). Через 24 нед. после окончания лечения анализировали объективный статус, показатели ВН ВГС и ВИЧ, общий и биохимический анализы крови, состояние иммунитета (количество СD4+-лимфоцитов). Для оценки эффективности терапии использовали показатель УВО, который определяли через 24 нед. после окончания курса лечения. Если сохранялась неопределяемая ВН, ответ на терапию расценивали как устойчивый.
Возможность межлекарственных взаимодействий АРП и препаратов для лечения ХГС и их коррекцию осуществляли с использованием онлайн-сервиса Liverpool HEP Interactions (www.hep-druginteractions.org).
Статистическую обработку данных проводили на персональном компьютере с использованием стандартных пакетов программ Statistica 7.0. и прикладных компьютерных программ пакета Microsoft Office 2007. Количественные показатели описывали с помощью среднего значения (М), стандартного отклонения (m), медианы (Me), минимума (min), максимума (max). Относительные показатели рассчитывали, определяя 95% доверительные интервалы (95% ДИ). Для качественных величин рассчитывали частоту встречаемости и проценты, для процентных долей – стандартную ошибку доли. При сравнении групп использованы методы оценки достоверности различий показателей (параметрические – t-криретий Стьюдента и непараметрические – критерий χ2).
Результаты и обсуждение
Характеристика участников исследования представлена в табл. 1.
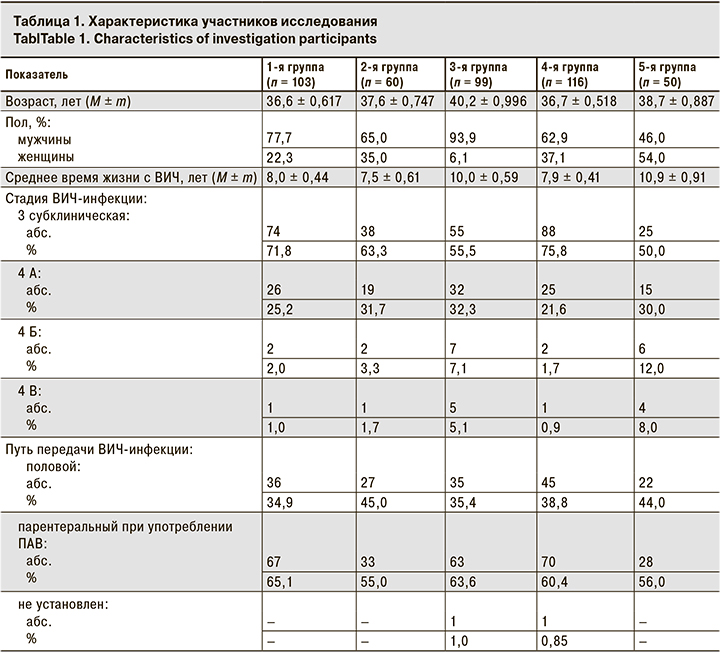
В возрастной структуре наибольший удельный вес (48,9%) приходится на долю лиц 30–40 лет, средний возраст составил 41,2 ± 0,353 (20,3–77,1) года, Ме – 40 лет, Мо (наиболее часто встречающееся значение выборки) – 39. Мужчины составляли 65,5%. 72,2% участников диагноз ВИЧ-инфекции был установлен менее 10 лет назад (основная когорта живет с диагнозом менее 5 лет). Среднее время жизни с ВИЧ – 8,7 ± 0,26 (2,0–26) года. По стадиям ВИЧ-инфекции больные распределились так: 3 субклиническую стадию имели 280 (65,4%) чел., стадию 4А – 117 (27,3%), 4Б – 119 (4,4%), 4В – 12 (2,9%).
Среди путей передачи ВИЧ-инфекции преобладал парентеральный при немедицинском употреблении психоактивных веществ (ПАВ) – 233 (60,1) чел., половой при гетеросексуальных контактах – 153 (39,4%) чел., в 2 (0,5%) случаях путь передачи не установлен.
У всех больных в анамнезе регистрировали 1 или несколько ВИЧ-ассоциированных заболеваний: генерализированную лимфаденопатию – у 252 (65,0%) больных, кандидоз ротоглотки – у 71 (18,3%), микобактериоз – у 22 (5,7%), другие вирусные инфекции – у 14 (3,6%), гематологические нарушения (анемия, тромбоцитопения) – у 12 (3,1%), бактериальные инфекции – у 9 (2,3%), микозы – у 2 (0,5%), пневмоцистную пневмонию в анамнезе – у 2 (0,5%), множественные инфекции – у 1 (0,25%), саркому Капоши – у 1 (0,25%), злокачественные новообразования – у 1 (0,25%), B22.0 – ВИЧ-энцефалопатию – у 1 (0,25%).
Кроме того, 64 (16,5%) больных имели коморбидные заболевания: болезни эндокринной системы, расстройства питания – 17 (26,6%) чел.; болезни органов пищеварения – 15 (23,4%); инфекции, передающиеся преимущественно половым путем – 14 (21,9%); вирусные инфекции, характеризующиеся поражениями кожи и слизистых оболочек – 12 (18,8%); психические расстройства и расстройства поведения, связанные с употреблением психоактивных веществ – 4 (6,2%); новообразования – 2 (3,1%).
В ходе наблюдения контролировали динамику биохимических показателей, в том числе АсАт и АлАТ (табл. 2).
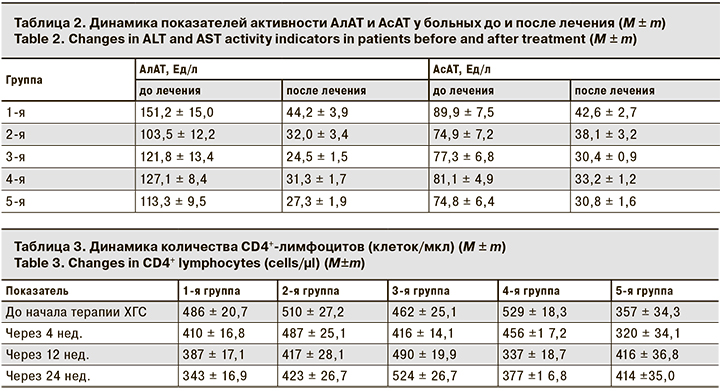
В 1-й группе больных после лечения АсАт и АлАт превышали нормальные показатели на 1–2%. В остальных группах отмечено достоверное снижение обоих показателей после лечения в 2 и более раз.
Оценивали также изменение количества СD4+-лимфоцитов до начала терапии, в процессе лечения и после его окончания (табл. 3).
Как следует из табл. 2, в 1-й, 2-й и 4-й группах количество СD4+-лимфоцитов достоверно снизилось в среднем на 127 ± 24,9 клеток/мкл (25,0 ± 4,8%): в 1-й группе – на 143 (29,2%), во 2-й – на 87 (17,1%), в 4-й – на 152 (28,7%). В 3-й и 5-й группах количество СD4+-лимфоцитов повысилось в среднем на 59,5 ± 3,5 клетки/мкл (14,6 ± 1,8%): в 3-й группе – на 62 (13,4%), в 5-й – на 57 (15,9%) (рис. 1).
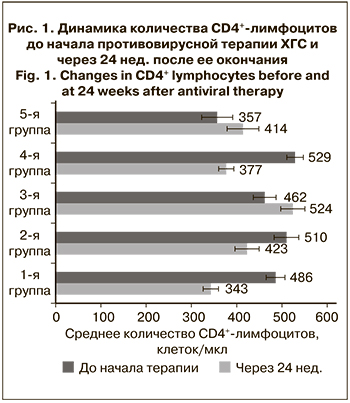
Это подтверждают и данные литературы. Так, у пациентов, получавших ПППД, в процессе лечения пул плазмоцитоидных дендритных клеток достиг нормальных показателей [24]. В то же время у больных 1-й, 2-й и 4-й групп, получавших ПегИФН, нарастали признаки иммунодефицита.
НЯ на фоне разных схем терапии, в том числе с применением ПППД, не были неожиданными, все они описаны в литературе [2, 6–8, 20–23, 25]. У всех участников исследования, принимавших ПегИФН, регистрировали НЯ различной степени, описанные в инструкции к препарату. При этом из-за возникновения НЯ у 19 (4,9%) больных терапия была прервана. Остальным участникам не потребовались снижение дозы или отмена препарата.
НЯ у больных, прервавших лечение:
1-я группа – у 5 (4,8%) больных регистрировали слабость, тромбоцитопению (число тромбоцитов уменьшилось до 26 х 109 г/л); нейтропению (число нейтрофилов 1,6 х 109 г/л); повышение уровня трансаминаз в 1,3 раз выше нормы; очаговые тени в легких, выявленные при флюорографии (в дальнейшем патологии не выявлено, туберкулез легких исключен).
2-я группа – у 4 (6,7%) больных регистрировали гриппоподобный синдром, анемию (снижение гемоглобина до 55 и 81 г/л), тромбоцитопению (число тромбоцитов уменьшилось до 17 х 109 г/л), рост ВН ВИЧ (с < 58 копий/мл до 5 log).
4 группа – у 10 (7,8%) выявлены слабость, анемия (снижение гемоглобина до 65, 72, 81 и 56 г/л), снижение количества СD4+-лимфоцитов (до 122 клеток/мкл), в том числе у 1 участника наблюдалась потеря массы тела на 15,7%.
Полный курс лечения завершили 367 (94,6%) больных, 19 (4,9%) прервали терапию из-за развития НЯ, 2 (0,5%) больных выбыли из наблюдения (потерян контакт с пациентами).
Эффективность противовирусной терапии оценивали по результатам вирусологического ответа через 4, 12 и 24 нед. после окончания лечения. Сравнивали долю больных с неопределяемой ВН РНК ВГС в группах. Результаты представлены на рис. 2
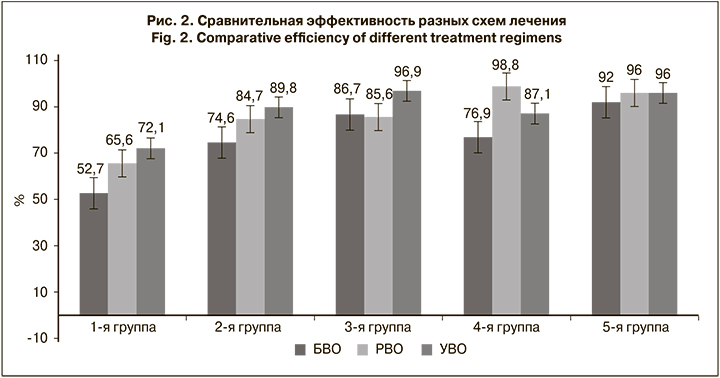
У 3 больных с ВГС генотипа 1, включенных в 3 группу, отмечена неэффективность терапии ПППД по схемам: даклатасвир + софосбувир (рецидив через 2 года), дасабувир + омбитасвир + паритапревир + ритонавир (рецидив через 1,5 года), гразопревир + элбасвир (неэффективность после 8 нед. лечения).
Благодаря противовирусной терапии можно добиться элиминации ВГС. Однако это не защищает от реинфицирования другим генотипом ВГС. В нашей практике было несколько подобных случаев. Один из них приводим ниже.
Пациентка П., 37 лет. ВИЧ-инфекция и ХГС диагностированы одновременно. Путь инфицирования ВИЧ – половой. Выявлен ВГС генотипа 3, ВН ВГС – 1,2 х 107 копий/ мл, количество СD4+-лимфоцитов – 40 клеток/ мкл, АлАТ – 125 Ед/л, АсАТ – 43 Ед/л. В течение 24 нед. получала лечение ХГС препаратами ИФН (пегитрон 120 мг/кг в неделю + рибавирин 800 мг в сутки). Достигнуты БВО и РВО; на 24-й неделе РНК ВГС не определяется.
Достигнут УВО: в течение 5 лет РНК ВГС не определялась. В конце 2018 г. обратилась к врачу-инфекционисту с жалобами на слабость, дискомфорт в правом подреберье, желтушное окрашивание слизистых оболочек и кожных покровов, однократное повышение температуры тела. Консультирована хирургом, терапевтом, гастроэнтерологом. Острая хирургическая патология исключена. Из анамнеза: употребление ПАВ отрицает. Имела незащищенные половые контакты с ВИЧ-инфицированным партнером-потребителем инъекционных ПАВ, инфицированным ВГС.
Результаты обследования: альфа-амилаза мочи – 2220 Ед/л, альфа-амилаза крови – 70 Ед/л, общий билирубин – 400 мкмоль/л, прямой билирубин – 296 мкмоль/л, АлАТ – 348 Ед/л, HBsAg отр., антиHAV – на момент госпитализации анализ не готов, РНК ВГС – на момент госпитализации анализ не готов. С подозрением на острый гепатит А желтушной формы направлена в инфекционный стационар. Анти-HAV не выявлены, острый гепатит А исключен. Диагностирован острый гепатит С, желтушная форма, средней степени тяжести. РНК ВГС положительный, генотип 1. Назначена терапия ПППД Викейра-Пак (дасабувир + омбитасвир + паритапревир + ритонавир) в течение 12 нед. Получен вирусологический ответ.
Таким образом, у больной, получившей эффективный курс противовирусной терапии ХГС, но не соблюдавшей мер профилактики, произошло реинфицирование другим генотипом ВГС. Поэтому в подобных ситуациях необходимо провести полный объем диагностических процедур по поиску этиологической причины заболевания.
Выводы:
1. Противовирусная терапия ХГС у больных ВИЧ-инфекцией, включающая ПегИФН и рибавирин, менее эффективна, чем тритерапия с добавлением в схему нарлапревира. ПППД показывают более высокую эффективность при любых генотипах ВГС по сравнению со схемой нарлапревир + ритонавир + пегинтерферон + рибавирин.
2. Учитывая достаточно высокую эффективность схем, включающих ПегИФН и рибавирин, независимо от генотипа вируса, допустимо использовать их у больных, ранее не получавших лечения, с учетом сопутствующей патологии и наличия противопоказаний. В условиях дефицита ПППД схемы с использованием ПегИФН востребованы до настоящего времени, что снижает социальную напряженность у больных ВИЧ- инфекцией и уменьшает их эпидемиологическую опасность
3. ПППД могут быть рекомендованы для лечения ХГС как у наивных пациентов, так и у пациентов с опытом терапии. Они показывают также высокую эффективность у пациентов с предыдущей вирусологической неудачей после лечения с использованием схем, включающих препараты ИФН.
4. Больные, получившие эффективный курс лечения, допускающие рискованное поведение, должны в дальнейшем находиться под наблюдением с регулярным контролем маркеров гепатитов (ПЦР РНК и ДНК, АТ), так как возможно реинфицирование как другими генотипами ВГС, так и вирусами других гепатитов. Кроме того, необходимо проводить профилактику инфицирования (вакцинация против гепатита В, защищенные половые контакты, профилактика наркомании).



