В последние десятилетия одним из самых распространенных в мире зоонозов является сальмонеллез. По заключению экспертов ВОЗ, сальмонеллез как зоонозная инфекция не имеет себе равных по сложности развития как эпизоотического, так и эпидемического процессов и трудностям борьбы с ними [1].
Продолжающийся рост заболеваемости сальмонеллезом во многих странах мира, увеличение числа выделяемых у животных и людей сероваров сальмонелл, контаминация сальмонеллами значительных объемов пищевых продуктов животного происхождения и объектов окружающей среды выдвигают эту инфекцию в ряд важнейших ветеринарных, медицинских, экологических и социальных проблем [2, 3].
Глобальный мониторинг за пищевыми инфекциями, проводимый ВОЗ в период с 1988 по 2000 г., показал, что 47% всех вспышек были вызваны сальмонеллами, из них 34% связаны с потреблением куриного мяса, при этом отмечено около 400 случаев со смертельным исходом. Материальные затраты оцениваются в 1–2,3 млрд долларов США в год, включая медицинские расходы, потери производительности труда, убытки производителей продуктов питания и предприятий общественного питания, а также затраты на научные исследования [4].
Среди острых кишечных инфекций, зарегистрированных в России в период с 2010 по 2015 г., сальмонеллезы составляли 5,8, 6,5, 6,4, 6,0, 5,2 и 4% [5]. При анализе распространенности сальмонеллезов, за исключением ОКИ неустановленной этиологии, эти цифры оказываются еще более значимыми: 17,3, 17,9, 17,0, 16,0, 22,0 и 12% соответственно.
В этиологической структуре сальмонеллезов у людей продолжают доминировать S. Enteritidis, составляющие 76,9% от всех идентифицированных сальмонелл. Эти же сальмонеллы чаще всего выделяют у животных, из пищевых продуктов и объектов окружающей среды.
Зарегистрированные на территории страны вспышки сальмонеллезов в подавляющем большинстве случаев также этиологически связаны с S. Enteritidis. Указанная моноэтиологичность сальмонелл, выделенных из разных источников, значительно осложняет эпидемиологическую диагностику, направленную на поиск основных источников возбудителя инфекции и факторов ее распространения, что требует расширения системы мониторинга за сальмонеллезами с обязательным включением в него дополнительного тестирования микроорганизмов [6].
Цель работы – использование молекулярно-генетических методов типирования, фаготипирования и определения спектра чувствительности к антибиотикам для характеристики сальмонелл, выделенных из разных источников, в том числе при вспышках сальмонеллезов.

Материалы и методы
Для комплексного изучения сальмонелл, выделенных на разных территориях страны, использовали штаммы, поступающие в Референс-центр по мониторингу за сальмонеллезами (Москва; далее – Референс-центр) с территорий его опорных баз.
Микроорганизмы были выделены у людей и животных, из пищевых продуктов и объектов окружающей среды при спорадических заболеваниях и в период вспышек сальмонеллезов.
 Штаммы, поступающие в Референс-центр, использовали для идентификации, серологического и молекулярно-генетического мониторинга. Идентификацию штаммов осуществляли с применением системы Api 20E («bioMerieux», Франция) и моноклональных реагентов Enteroclons («SIFIN», Германия) для серотипирования Salmonella.
Штаммы, поступающие в Референс-центр, использовали для идентификации, серологического и молекулярно-генетического мониторинга. Идентификацию штаммов осуществляли с применением системы Api 20E («bioMerieux», Франция) и моноклональных реагентов Enteroclons («SIFIN», Германия) для серотипирования Salmonella.
Чувствительность к антибиотикам определяли на пластинках ATBТМ G-5 («bioMerieux», Франция).
Фаготипирование S. Enteritidis проводили с использованием коллекции типовых фагов для типирования S. Enteritidis, разработанной Национальным институтом гигиены (Венгрия).
Pattern-структуру штаммов определяли с помощью анализа набора продуктов рестрикции тотальной ДНК в пульсирующем электрическом поле – пульс-электрофорез (Pulsed Field Gel Electrophoresis – PFGE) с использованием протоколов Pulse Net International Network. Обработку полученных данных проводили с помощью программного комплекса Bionumerix 6.6 («Applied Maths», США). Термин «pattern-комбинация» использовали при анализе дендрограмм гомологии PFGE профилей исследуемых изолятов с использованием эндонуклеаз рестрикции XbaI и BlnI.
Данные о чувствительности к антибиотикам сальмонелл, выделенных от животных, получены диско-диффузионным методом и любезно предоставлены нам О.Н. Витковой (ФГБУ «Центр ветеринарии», Москва).
Результаты
За период 2011–2016 гг. в Референс-центр поступили 4240 штаммов сальмонелл (в 2011 г. – 813, в 2012 г. – 656, в 2013 г. – 773, в 2014 г. – 578, в 2015 г. – 615, в 2016 г. – 805). Указанные микроорганизмы были выделены на разных территориях страны (в 2011 г. – на 22 территориях, в 2012 г. – на 27, в 2013 г. – на 31, в 2014 г. – на 25, в 2015 г. – на 27, в 2016 г. – на 31) и являлись представителями разных сероваров (в 2011 г. – 40 сероваров, в 2012 г. – 35, в 2013 г. – 46, в 2014 г. – 51, в 2015 г. – 34, в 2016 г. – 50). Несмотря на столь пестрый сероваровый пейзаж изученных сальмонелл, подавляющее число штаммов составляли S. Enteritidis: в 2011 г. – 71,3%, в 2012 г. – 54,6%, в 2013 г. – 62,0%, в 2014 г. – 39,5%, в 2015 г. – 64,0%, в 2016 г. – 50,0%. Затем следовали S.Typhimurium (в 2011 г. – 5,1%, в 2012 г. – 6,5%, в 2013 г. – 6,7%, в 2014 г. – 5,8%, в 2015 г. – 3,0%, в 2016 г. – 2,0%). Завершали тройку ведущих сероваров S. Infantis (в 2011 г. – 5,9%, в 2012 г. – 6,5%, в 2013 г. – 6,7%, в 2014 г. – 4,8%, в 2015 г. – 9,0%, в 2016 г. – 5,0%). При этом значимость указанных сальмонелл постоянно увеличивалась.
Идентификация поступивших в Референс-центр штаммов показала, что в ряде случаев были допущены диагностические ошибки, которые, в первую очередь, были связаны с ошибочным определением серовара сальмонелл. В 2011 г. такая ошибка касалась 24 штаммов, при этом у 4 культур была неправильно определена даже О-группа. В 2012 г. подобный результат выявлен у 45 штаммов (в 3 случаях это касалось О-группы). В 2013 г. в 69 случаях идентификация была проведена ошибочно, в том числе у 5 штаммов это касалось О-групповой принадлежности. В 2014 г. такие ошибки отмечены в 22 случаях (в 2 – при определении О-группы), в 2015 г. – в 20 случаях (у 5 штаммов была неправильно определена О-группа) и, наконец, в 2016 г. ошибочно идентифицированы 7 штаммов. Достаточно часто в Референс-центр поступают культуры сальмонелл, идентификация которых завершалась после определения О-групповой принадлежности (74 штамма в 2011г., 45 – в 2012 г., 83 – в 2013г., 44 – в 2014 г., 65 – в 2015 г. и 36 – в 2016 г.). В ряде случаев возникли трудности с определением Н-антигена второй фазы.
В число изученных штаммов вошли микроорганизмы, выделенные при 160 вспышках сальмонеллезов (в 2011 г. – при 23, в 2012 г. – при 27, в 2013 г. – при 30, в 2014 г. – при 25, в 2015 г. – при 25 и в 2016 г. – при 38), из них 148 (88%) этиологически были связаны с S. Enteritidis. Кроме того, в 2011г. были зарегистрированы вспышки, вызванные S. Braenderup (1), S. Isangi (1), S. Istanbul (1), S. Typhimurium (1); в 2012 г. – S. Oranienburg (2), S. Typhimurium (1), S. Infantis (1), S. Braenderup (1), S. Montevideo (1); в 2013 г. – S. Senftenberg (2), S. Typhimurium (1), S. Poona (1), S. Kimberly (1), S. Muenchen (1), S. Thompson (1). В 2014 г. 2 вспышки были вызваны S.Typhimurium. В 2015 г., кроме вспышек, вызванных S. Enteritidis, 1 была связана с S. Litchfield.
Как видно из представленных материалов, S. Enteritidis являлась ведущим сероваром не только при спорадических сальмонеллезах, но и при вспышках.
Мониторинг за сальмонеллезами предполагает проведение обязательного типирования выделенных штаммов на основе фенотипических и генотипических свойств возбудителей.
В качестве фенотипических методов чаще всего используются фаготипирование и определение чувствительности к действию антимикробных препаратов.
Мониторинг за чувствительностью к антибиотикам штаммов, выделенных из разных источников, является существенной частью эпидемического надзора за сальмонеллезами и рассматривается как своеобразный инструмент надзора [7, 8]
Наиболее распространенным молекулярно-генетическим методом типирования штаммов сальмонелл является PFGE [9, 10].
В период с 2011 по 2016 г. проведено фаготипирование 2517 штаммов S. Enteritidis. При этом оказалось, что 2153 (85%) штаммов относились к фаготипу 1. Затем по частоте встречаемости следовали фаготипы 1а (4%) и 19 (3%). Представители еще 8 фаготипов встречались крайне редко [фаготипы 20 (16 положительных находок), 17 (38), 1d (10), 2 (3), 21 (2), 12 (2), 2а (1) и 3а (1)] и составляли менее 1% от числа изученных штаммов. В 62 (2,5%) случаях S. Enteritidis не укладывались в схему типирования (нетипируемые микроорганизмы), а 80 (3,2%) культур не лизировались типовыми фагами (так называемые отрицательные)
Из 140 вспышек, этиологически связанных с S. Enteritidis, в 127 (90%) случаях микроорганизмы, выделенные как у больных, вовлеченных в эти вспышки, так и из факторов передачи возбудителей инфекции и объектов окружающей среды, являлись представителями фаготипа 1. Кроме того, 3 относились к фаготипу 2а, по 2 – к фаготипам 19 и 20 и 1 – к фаготипу 17. В 3 случаях S.Enteritidis не укладывались в схему типирования, а в 2 вспышках выделенные сальмонеллы не лизировались типовыми фагами.
Была изучена чувствительность к антибиотикам 543 штаммов сальмонелл 46 различных сероваров. 243 (44,75%) микроорганизма относились к S. Enteritidis, 87 (16,0%) – к S. Infantis и 46 (8,47%) – к S. Typhimurium. Остальные серовары представлены единичными находками.
Учитывая, что указанные 3 серовара определяли 69,24% всех случаев выделения сальмонелл из разных источников, тщательное изучение чувствительности к антибиотикам проведено именно у таких возбудителей сальмонеллезов. Из 243 штаммов S. Enteritidis 91 (32,45%) был чувствителен к действию всех изученных антибиотиков. Среди штаммов с некоторой устойчивостью к антибиотикам чаще всего выявляли устойчивость к цефуроксиму (62 штамма – 25,51%) и цефалотину (31 штамм – 12,75%) амоксициллину (8 штаммов – 3,29%), тикарциллину (9 штаммов – 3,7%), тикарциллину/клавуланату (8 штаммов – 3,29%). Устойчивость к другим антимикробным препаратам встречалась реже.
В то же время у 2 штаммов S. Enteritidis выявлена одновременная устойчивость к 8 и 10 препаратам, у 2 – к 9, у 1 – к 7, у 2 – к 6, у 1 – 5 и 4 препаратам. У 1 штамма S. Enteritidis обнаружена устойчивость к ципрофлоксацину.
Определение антибиотикочувствительности у S. Typhimurium показало, что из 46 штаммов только 9 (19,56%) были чувствительны ко всем антибиотикам. 19 (41,3%) штаммов были устойчивы к амоксициллину, столько же – к пиперациллину, 18 (39,1%) – к тикарциллину, 12 (26,1%) – к тикарциллину/клавуланату и 11 (23,9%) – к цефалотину. Одновременной устойчивостью к действию 3 препаратов обладали 17 (36,95%) культур, по 1 штамму были устойчивы к действию 4, 7 и 9 препаратов.
У S. Infantis из 87 штаммов только 28 (32,18%) были чувствительны ко всем антибиотикам. У 11(12,64%) штаммов данного серовара обнаружена устойчивость к амоксициллину, у 5 (5,74%) – к амоксициллину/клавуланату, у 9 (10,34%) – к пиперациллину, у 10 (11,49%) – к тикарциллину и тикарциллину/клавуланату. У 26 (29,89%) штаммов выявлена резистентность к цефалотину, у 23 (26,44%) – к цефокситину, у 45 (51,72%) – к цефуроксиму парентерально, у 12 (13,79%) – к цефтазидиму 1, у 10 (11,49%) – к ко-тримоксазолу. В то же время выявлены единичные штаммы, устойчивые к цефотаксиму, цефтазидиму, тобрамицину, амикацину, гентамицину, нетилмицину и ципрофлоксацину.
Гораздо чаще, чем у S. Enteritidis и S. Typhimurium, у S. Infantis встречались полирезистентные микроорганизмы (табл. 1), которые имели спектры резистентности состоящие из 2 и более антибиотиков.
Следует отметить, что у 20 штаммов выявлена резистентность к одному из пенициллинов 3-го поколения (AMO, PIC, TIC), в том числе у 12 – к препаратам, содержащим ингибиторы β-лактамаз (AMC, TZP, TCC); у 36 штаммов – к цефалоспоринам (CFT, CXT, CXM, CTX, CAZ, CA1, FEP). 21 сальмонелла была устойчива к аминогликозидам 2-го и 3-го поколения (TOB, AKN, GEN, NET), 1 – к действию фторхинолона и 1 – к ко-тримоксазолу. Однако общее число антибиотикоустойчивых штаммов невелико.
Таким образом, установлено, что сальмонеллы разных сероваров имеют разную степень чувствительности к действию антибиотиков. Среди доминирующих сероваров сальмонелл наибольшее число чувствительных штаммов выявлено среди S. Enteritidis, устойчивых – среди S.Typhimurium; S. Infantis занимала промежуточное положение.
Анализ данных об устойчивости к антибиотикам сальмонелл, не относящихся к ведущим сероварам, подтвердил, что подавляющее их большинство также было чувствительно к антибиотикам, входящим в панель АТВТМ G-5. Из 167 штаммов 43 сероваров 144 (86,22%) были чувствительны к действию всех препаратов. У 23 (13,77%) таких микроорганизмов, относящихся к 12 сероварам, была выявлена не только устойчивость к некоторым антибиотикам (табл. 2), но и одновременная резистентность к 3 и более препаратам. Впервые у S. Montevideo обнаружена устойчивость к 16 антимикробным препаратам. Микроорганизмы этой группы чаще всего были устойчивы к действию амоксициллина (19 из 23 штаммов), пиперациллина (19 из 23 штаммов) и тикарциллина (19 из 23 штаммов), тикарциллина/клавуланата (16 из 23 штаммов), цефалотина (13 из 23 штаммов), цефуроксима (10 из 23 штаммов), ко-тримоксазола (10 из 23 штаммов). У 5 штаммов обнаружена устойчивость к ципрофлоксацину. У 2 штаммов выявлена одновременная резистентность к аминогликозидам (тобрамициу, гентамицину и амикацину) и у 3 – к гентамицину.
Учитывая, что в литературных источниках преобладает точка зрения, связывающая формирование антибиотикоустойчивости штаммов сальмонелл с частым использованием антимикробных препаратов в ветеринарии, нами были проанализированы представленные ФГБУ «Центральная научно-методическая ветеринарная лаборатория» в Референс-центр данные о распространенности резистентных сальмонелл, выделенных от животных в 2012 г. К антибиотикам, часто применяемым для лечения сальмонеллезов у животных, относятся гентамицин, канамицин, тетрациклин, ампициллин, энрофлоксацин, неомицин, левомецитин. Выявлена высокая устойчивость сальмонелл к препаратам группы пенициллинов (ампициллин – 61,75%, бензилпенициллин – 64,26%), аминогликозидам 1-го поколения (неомицину – 74,16%, канамицину – 52,79%), тетрациклинам (тетрациклину – 58,0%, доксициклину – 44,87%), циклическим пептидам (полимиксин – 48,03%) (табл. 3).
В число препаратов, используемых в ветеринарии, входят и те, которые выпускаются для медицинских целей (амикацин, рифампицин, цефалексин, цефтазидим, цефаперазон, цефепим, тобрамицин, меропенем, цефалотин, имипенем, цефуроксим, тикарциллин и др.). Число штаммов сальмонелл, обладающих устойчивостью к таким препаратам, достигало 51,14% (амикацин), 55,48% (цефалексин), 51,38% (тобрамицин), 49,93% (меропенем) и т. д.
При сравнении этих результатов с данными о чувствительности к антибиотикам штаммов сальмонелл, выделенных от людей, из продуктов питания и объектов окружающей среды, становится очевидным, что резистентность к антибиотикам встречается среди микроорганизмов, выделенных у животных, чаще, чем в изолятах от людей. Возможно, это связано с тем, что антибиотики очень редко применяют для лечения людей, больных сальмонеллезом. В то же время единичные находки сальмонелл, полирезистентных к действию широкого спектра антибиотиков, в том числе и в изолятах из объектов окружающей среды (сточные воды, вода открытых водоемов и т. д.), не позволяют полностью исключить роль излишнего использования антимикробных препаратов в качестве одного из факторов, способствующих формированию устойчивых к антибиотикам штаммов сальмонелл, выделенных от людей.
Действующая в России система эпидемиологического надзора за сальмонеллезами в последние годы дополнена элементами молекулярно-генетического типирования с использованием в первую очередь метода PFGE.
Выявляемая pattern-структура сальмонелл позволяет объективно оценить эпидемическую ситуацию, подтвердить или отвергнуть роль определенных источников возбудителей инфекции или факторов ее распространения.
Особенную значимость приобретает проведение таких исследований во время вспышек сальмонеллезов, когда доказанная с их помощью роль отдельных продуктов питания позволяет не только предотвратить дальнейшее распространение заболеваний, но и принять меры в отношении виновников возникновения вспышек [11].
Проведенное молекулярно-генетическое типирование 1844 штаммов сальмонелл, в первую очередь, S. Enteritidis (1522), S. Typhimurium (111) и S. Infantis (181), поступивших в Референс-центр с января 2010 г. по август 2016 г., показало, что на разных территориях страны циркулируют сальмонеллы, относящиеся к одним и тем же PFGE pattern. В число S. Enteritidis, подвергшихся молекулярно-генетическому типированию, вошли 1180 штаммов, выделенных от людей, 294 изолятов из пищевых продуктов и 68 – из объектов окружающей среды. Как видно из табл. 4, наибольшее многообразие pattern-комбинаций (64) выявлено у штаммов S. Enteritidis, выделенных от людей. При этом ведущим являлся PFGE-профиль JEGX01.0001–JEGA26.0001, характерный для 68,39% таких штаммов. Рattern-комбинация JEGX01.0005–JEGA26.0006 обнаружена у 5,93% штаммов, JEGX01.0001–JEGA26.0004 – у 4,83%. Остальные представлены единичными штаммами.
Ведущий среди изолятов от людей PFGE-профиль S. Enteritidis оказался таким же и среди сальмонелл, выделенных из пищевых продуктов и объектов окружающей среды, где он представлен 58,5 и 66,18% штаммов соответственно. При этом в штаммах, выделенных из пищевых продуктов, зарегистрировано 29 PFGE-профилей, а из объектов окружающей среды – 12. Второй по частоте встречаемости штаммов, выделенных от людей и из пищевых продуктов, являлась pattern-комбинация JEGX01.0005–JEGA26.0006 (5,93 и 5,78% соответственно).
При молекулярно-генетическом типировании S. Typhimurium (табл. 5) у штаммов, выделенных от людей, обнаружено 42 pattern-комбинации, ведущей из которых являлась JPXX 01.0013–JPXA 26.0009: на ее долю приходилось 21,7% всех PFGE pattern, затем следовали JPXX01.0020–JPXA26.0014 (13,25%) и JPXX01.0026–JPXA26.0020 (8,43%). Остальные находки не превышали 2–3%.
В группе S. Typhimurium, выделенных из продуктов, обнаружено 6 pattern-комбинаций, встречавшихся с одной и той же частотой, а у штаммов данного серовара, выделенных из объектов окружающей среды, – 22 pattern-комбинации. Чаще всего они относились к JPXX01.0029– JPXA26.0025 (22,73%) и JPXX01.0032– JPXA26.0027 (13,64%).
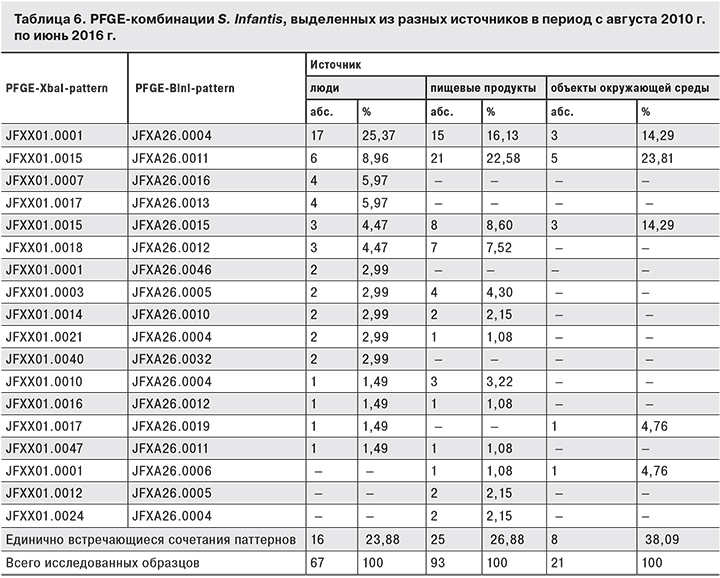
Весьма интересны материалы, касающиеся молекулярно-генетического типирования S. Infantis. В этой группе штаммов преобладали микроорганизмы, выделенные из пищевых продуктов (93 штамма), среди которых выявлена циркуляция 38 pattern-комбинаций. Ведущими являлись JFXX01.0015–JFXA26.0011 (22,58%) и JFXX01.0001–JFXA26.0004 (16,12%) (табл. 6). При этом те же комбинации преобладали у штаммов, выделенных от людей. Из объектов окружающей среды чаще выделяли S. Infantis, относящиеся к pattern-комбинациям JFXX01.0015–JFXA26.0011 (23,81%), JFXX01.0001–JFXA26.0004 (14,29%) и JFX01.0015–JFXA26.0015 (14,29%).
В рамках настоящего исследования была предпринята попытка использовать PFGE-анализ для идентификации штаммов, не имеющих Н-антигенов первой или второй фазы, что делало невозможным их полную идентификацию. Были отобраны 30 штаммов сальмонелл, у которых отсутствовали Н-антигены второй фазы. Учитывая, что сальмонеллы одного и того же серовара имели сходную pattern-комбинацию, в то время как сальмонеллы разных сероваров обладали разными Xba1/Bln1-pattern-комбинациями. В собранной нами базе данных имеются материалы об исследовании в PFGE штаммов определенных сероваров, от которых трудно диагностируемые культуры отличались только отсутствием одного из Н-антигенов. В тех случаях, когда такие микроорганизмы имели полностью идентичные pattern-комбинации со штаммами определенного серовара, с большой вероятностью можно было заключить, что сальмонеллы, характеризующиеся принадлежностью к одним и тем же pattern-комбинациям, относятся к одному и тому же серовару. Например, штамм, содержащий О-антигены 6, 7, 14; Н-r (Н-антиген 1,5 2-й фазы отсутствует) и имеющий PFGE-профиль JFXX01.0001–JFXA 26.0004, является S. Infantis.
Заключение
Проведено исследование штаммов сальмонелл, поступивших в Референс-центр по мониторингу за сальмонеллезами в 2011–2016 гг. Микроорганизмы были выделены из разных источников при спорадических заболеваниях и во время вспышек. В число изученных вошли изоляты, выделенные от людей и животных, из пищевых продуктов и объектов окружающей среды. S. Enteritidis, S. Typhimurium и S. Infantis доминировали в этиологической структуре сальмонеллезов у людей и животных и в сероваровом пейзаже сальмонелл, выделенных из объектов окружающей среды.
В рамках эпидемиологического надзора за сальмонеллезами проведен мониторинг, включающий серотипирование, фаготипирование, определение чувствительности к антибиотикам и молекулярно-генетическое типирование (PFGE) выборочного числа штаммов.
Установлено, что 85% S. Enteritidis, выделенных из разных источников, относились к фаготипу 1. Представители данного серовара в 37,45% случаев были чувствительны ко всем испытанным антибиотикам.
Среди S.Typhimurium только 19,56% были чувствительны к действию всех антибиотиков, а среди S. Infantis обнаружено 32,18% таких штаммов.
Среди штаммов сальмонелл, обладающих устойчивостью к некоторым антибиотикам, преобладала резистентность к амоксициллину, амоксициллину/клавуланату, пиперациллину, тикарциллину и цефалотину.
Штаммы, устойчивые к действию нескольких антибиотиков, преобладали среди S. Infantis. Среди микроорганизмов неведущих сероваров также преобладали чувствительные ко всем антибиотикам – они составляли 76%.
Проведенное молекулярно-генетическое типирование показало, что на разных территориях страны циркулируют сальмонеллы, относящиеся к одним и тем же PFGE pattern.
Наибольшее многообразие pattern-комбинаций (64) выявлено у штаммов S. Enteritidis. Ведущим являлся PFGE-профиль JEGX01.0001–JEGA26.0001, характерный для 67% таких штаммов.
У S. Typhimurium, выделенных от людей, обнаружено 42 pattern-комбинации, ведущей из которых была JPXX01.0013–JPXA26.0009 (21,7%) .
В группе штаммов S. Infantis выявлены 38 pattern-комбинаций, при этом ведущей являлась JFXX01.0015–JFXA26.0011 (22,6%).
Предпринята попытка использовать PFGE-анализ для идентификации трудно диагностируемых сальмонелл.



