Противовирусная терапия (ПВТ) хронического гепатита С (ХГС) за время своего существования претерпела значительную эволюцию (рис. 1). Более двух десятилетий практически безальтернативной схемой лечения являлась комбинация препаратов интерферона-α (стандартного или пегилированного – ПегИФН) с рибавирином (RBV). Действуя преимущественно через иммунную систему организма больного, такой вариант терапии сопровождался широким спектром и высокой частотой развития нежелательных явлений (НЯ), демонстрируя при этом довольно низкую эффективность.
Принципиально иным подходом в ПВТ явилось создание препаратов прямого противовирусного действия (ПППД), непосредственно влияющих на белки вируса гепатита С (ВГС). В соответствии с белком ВГС, служащим мишенью для ПППД, выделяют 3 основных класса таких препаратов: ингибиторы NS3/4A-протеазы, ингибиторы NS5B-полимеразы и ингибиторы NS5A-белка репликативного комплекса.
В 2011 г. появились трехкомпонентные схемы ПВТ, представляющие собой сочетание ПегИФН и RBV с ПППД. Такой подход позволил повысить эффективность лечения, но сделал терапию еще менее безопасной. Широта спектра и частота развития НЯ ПВТ при применении трехкомпонентных схем (особенно, включавших ингибиторы вирусной протеазы первой волны) достигли в этот момент своего пика. Появление ингибиторов протеазы второй волны улучшило ситуацию с эффективностью и безопасностью терапии.
В 2013 г. в подходах к лечению ХГС произошли революционные изменения. Появились существенно более безопасные схемы терапии, в которых препарат ИФН-α уже не являлся обязательным компонентом. Довольно быстро после начала применения безинтерфероновых вариантов ПВТ стало ясно, что монотерапия ПППД (даже с очень хорошими характеристиками) не позволяет достигать желаемых результатов, и для обеспечения максимальной эффективности лечения необходимо комбинирование ПППД (для одновременного воздействия на несколько белков вируса).
Современная терапия ХГС представляет собой сочетанное применение нескольких ПППД с добавлением (в некоторых случаях) RBV.
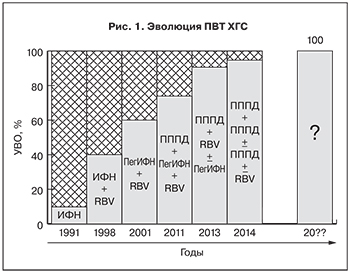 Несмотря на неуклонный рост эффективности ПВТ и приближение ее к абсолютным показателям, продолжает накапливаться пул больных ХГС, не достигших устойчивого вирусологического ответа (УВО) после курса лечения (см. рис. 1). Такие пациенты, безусловно, относятся к категории «сложных» и требуют к себе особого, сугубо индивидуализированного подхода. Только детальное изучение причин неэффективности проведенного лечения, уточнение индивидуальных характеристик пациента и некоторых особенностей вируса позволяют разработать оптимальную стратегию для «перелечивания» конкретного больного ХГС, имеющего неудачный опыт предыдущей ПВТ.
Несмотря на неуклонный рост эффективности ПВТ и приближение ее к абсолютным показателям, продолжает накапливаться пул больных ХГС, не достигших устойчивого вирусологического ответа (УВО) после курса лечения (см. рис. 1). Такие пациенты, безусловно, относятся к категории «сложных» и требуют к себе особого, сугубо индивидуализированного подхода. Только детальное изучение причин неэффективности проведенного лечения, уточнение индивидуальных характеристик пациента и некоторых особенностей вируса позволяют разработать оптимальную стратегию для «перелечивания» конкретного больного ХГС, имеющего неудачный опыт предыдущей ПВТ.
Ключевые факторы неэффективности ПВТ
Всех больных ХГС, имеющих неудачный опыт ПВТ, очевидно, можно условно разделить на 3 группы:
- Безуспешно леченные (ПегИФН с RBV).
- Не ответившие на трехкомпонентную терапию (ПегИФН, RBV и ПППД).
- Не достигшие УВО после безинтерферонового курса лечения (одного или нескольких ПППД в сочетании с RBV или без него).
Основным фактором, ассоциированным с низкой эффективностью терапии на основе ПегИФН, является недостаточная чувствительность пациента к действию ИФН-α. Именно эта почти не модифицируемая особенность организма является залогом неудачи первичного курса лечения у двух первых групп больных ХГС с неудачным опытом ПВТ в анамнезе.
У пациентов, не достигших УВО после безинтерферонового курса лечения, главной причиной неудачи является наличие у ВГС клинически значимой устойчивости (резистентности) к применяемым ПППД.
В организме больного обычно существует гетерогенная популяция вируса (в том числе различные резистентные варианты). Очень высокая репликативная активность ВГС, характеризующаяся появлением > 1012 новых вирусных частиц в день, сопряжена с высокой частотой образования вариантов вируса, имеющих определенные точечные аминокислотные замены, обусловливающие лекарственную устойчивость. Резистентные варианты ВГС, имеющие одну или несколько мутаций устойчивости, появляются постоянно в большом количестве. Ежедневно воспроизводится почти 1011 вирусов с единичными и > 109 – с двойными мутациями. Некоторые из этих вариантов ВГС нежизнеспособны и самостоятельно элиминируются, другие могут длительно персистировать, сохраняя резистентные свойства [1].
Описано значительное количество аминокислотных замен в регионах NS3/4A-протеазы, NS5B-полимеразы и в NS5A-белка репликативного комплекса ВГС, которые формируют мутации в указанных сегментах вирусного генома. Основные (первичные) мутации приводят к нарушению связывания ПППД с каталитическим центром соответствующего фермента и, как следствие, ослаблению ингибирующего влияния препарата на репликацию вируса.
 При терапии ПППД вирусная нагрузка вначале быстро, а затем плавно снижается за счет эффективного подавления чувствительных вариантов вируса (дикого типа), доминирующих на старте лечения. При достаточной продолжительности такого прессинга можно добиться полной элиминации вируса дикого типа. В противном случае он вновь формирует доминирующую популяцию в течение нескольких месяцев после отмены ПППД. Популяция резистентных вариантов ВГС, присутствующих в начале терапии, как правило, в незначительном количестве, при этом может расти в геометрической прогрессии и приводить к неудаче лечения.
При терапии ПППД вирусная нагрузка вначале быстро, а затем плавно снижается за счет эффективного подавления чувствительных вариантов вируса (дикого типа), доминирующих на старте лечения. При достаточной продолжительности такого прессинга можно добиться полной элиминации вируса дикого типа. В противном случае он вновь формирует доминирующую популяцию в течение нескольких месяцев после отмены ПППД. Популяция резистентных вариантов ВГС, присутствующих в начале терапии, как правило, в незначительном количестве, при этом может расти в геометрической прогрессии и приводить к неудаче лечения.
Формирование резистентности зависит не только от свойств препарата, но и от особенностей вируса и некоторых характеристик пациента. Одним из основных качеств вируса является его фитнес – способность выживать и размножаться в организме (в том числе и при подавляющей активности противовирусного препарата). Для формирования клинически значимой резистентности варианты ВГС, устойчивые к действию ПППД в силу наличия определенных мутаций, должны быть способны заполнить собой пространство, освобожденное под влиянием ПВТ вирусом дикого типа. Поэтому штаммы ВГС, обладающие устойчивостью к действию препарата, но репликативно слабые, клинически не столь значимы в плане неэффективности лечения, как варианты, способные активно размножаться на фоне терапии.
Существенное значение для успеха лечения имеет размер резистентной популяции вируса на старте ПВТ. Шансы на достижение пациентом УВО обычно тем ниже, чем больше имеющаяся у него популяция ВГС со сниженной чувствительностью к применяемым ПППД.
Частота исходного выявления вариантов вируса, ассоциированных с резистентностью, у не леченных ранее пациентов обычно не превышает 20%, но, очевидно, может отличаться в различных популяциях [2–5].
У российских пациентов с ВГС субтипа 1b, ранее не получавших ПВТ, по нашим данным, некоторые варианты мутаций устойчивости в регионе NS5B выявляются существенно чаще: например, вариант L159F обнаружен у 34% обследованных [6].
После окончания неудачного курса ПВТ, включавшего один или несколько ПППД, частота выявления резистентных вариантов, как правило, резко возрастает, достигая иногда 90%. При этом у одного больного может выявляться вирус, имеющий сразу несколько мутаций устойчивости (в одном, двух и даже трех регионах вирусного генома) [7].
Длительность персистирования в организме пациента резистентных вариантов ВГС после неудачной терапии с ПППД зависит от региона вируса, в котором сформировались аминокислотные замены, ассоциированные с лекарственной устойчивостью. Дольше остальных (более года после окончания ПВТ с ПППД соответствующего класса) выявляются мутации устойчивости в регионе NS5A. Длительное существование у больного крупной популяции резистентных вариантов вируса может создавать серьезные проблемы при проведении повторного курса лечения.
Непременным условием эффективного воздействия на вирус является адекватное количество лекарственного вещества, доходящее до места его действия в организме. В связи с этим важно помнить, что свой вклад в неудачу ПВТ могут вносить факторы, ухудшающие биодоступность применяемых препаратов. Нарушение больным графика приема лекарства, имеющиеся у пациента сопутствующие заболевания желудочно-кишечного тракта, индуцирование системы цитохрома другими лекарственными средствами, принимаемыми одновременно с ПВТ, могут значимо влиять на способность препарата достигать концентраций, достаточных для подавления репликации не только ВГС дикого типа, но и его менее чувствительных к терапии вариантов.
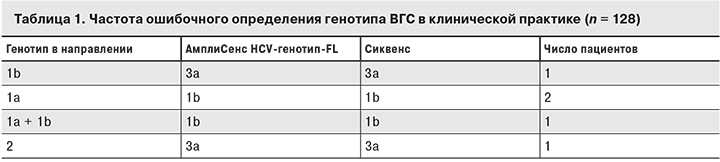
Еще одной причиной неудачи ПВТ может служить неверное исходное определение генотипа вируса. По нашим данным, частота ошибочного определения генотипа ВГС в отечественной клинической практике может достигать 4%. Из 128 больных ХГС, направленных в Референс-центр по мониторингу за вирусными гепатитами (Москва) в 2016 г. для уточнения этого параметра, у 5 (3,9%) генотип вируса изначально был определен неправильно (табл. 1).
Особенно высокой цена ошибки может оказаться в случае неточного генотипирования рекомбинантных вариантов ВГС. При повторном исследовании в лаборатории Референ-центра по мониторингу за вирусными гепатитами у 116 (41%) из 283 пациентов вирус, первоначально отнесенный к генотипу 2, оказался рекомбинантом 2k/1b. Пациент, инфицированный таким вирусом, нуждается в назначении более мощных схем ПВТ, ориентированных на ВГС генотипа не 2, а 1.
Все перечисленные факторы, ассоциированные с неэффективностью проведенной ПВТ у больного ХГС, необходимо анализировать и принимать в расчет при планировании повторного курса лечения для такого пациента.
Современные возможности повторного лечения больных, инфицированных ВГС генотипа 1
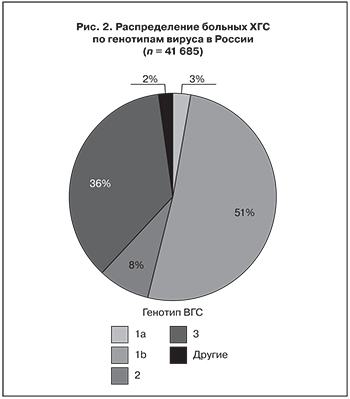
По данным Регистра больных вирусными гепатитами (рис. 2), на территории нашей страны наиболее широко распространен ВГС генотипа 1. Длительное время (в период проведения ПВТ ПегИФН с RBV) именно у больных с этим генотипом вируса отмечалась самая низкая эффективность лечения (по сравнению с пациентами, инфицированными ВГС генотипов 2 или 3).
Широкая распространенность в сочетании с длительным отсутствием приемлемой по эффективности терапии привели к тому, что среди этой категории больных накопилось наибольшее число «неответчиков».
Для больных ХГС, вызванным ВГС генотипа 1, с неудачным опытом лечения ПегИФН в сочетании с RBV имеются самые широкие возможности выбора повторного курса ПВТ (рис. 3). Несмотря на то, что 3 комбинации препаратов – софосбувир/ледипасвир (SOF/LDV), софосбувир/велпатасвир (SOF/VEL) и гразопревир/элбасвир (GZR/EBR) – пока не зарегистрированы в нашей стране, в арсенале отечественных специалистов имеются 4 эффективные и безопасные схемы ПВТ, подходящие для таких пациентов: паритапревир/ритонавир/омбитасвир + дасабувир (PTV/r/OBV + DSV), даклатасвир + асунапревир (DCV + ASV), софосбувир + симепревир (SOF + SMV), софосбувир + даклатасвир (SOF + DCV).
Описанные комбинации также могут быть рассмотрены для пациентов, имеющих в анамнезе неудачный опыт лечения SOF (в качестве монотерапии, в паре с RBV или в сочетании с ПегИФН и RBV).
Для больных ХГС, не ответивших на трехкомпонентную терапию ПегИФН с RBV и ингибитором NS3/4A-протеазы [телапревиром (TVR), боцепревиром (BOC) или SMV], эксперты EASL [8] рекомендуют 3 комбинации: SOF/LDV, SOF/VEL, SOF + DCV. В Российской Федерации пока зарегистрированы препараты, входящие только в последнюю из перечисленных опций.
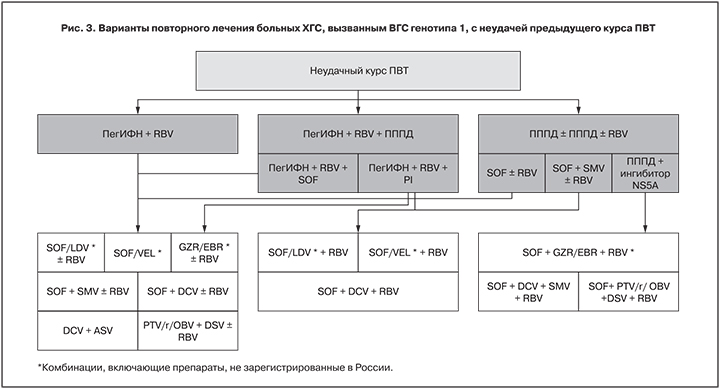
Эти же варианты терапии рекомендуется рассмотреть для «перелечивания» пациентов, получавших ранее SOF с SMV.
Эксперты AASLD для повторного лечения пациентов, имеющих неуспешный опыт лечения ПегИФН с RBV и ингибитором NS3/4A-протеазы, рекомендуют также комбинацию GZR/EBR + RBV [9].
Наиболее сложные комбинации предлагаются для повторного курса лечения больных, не достигших УВО после безинтерфероновой ПВТ, включавшей ингибитор NS5A-белка репликативного комплекса ВГС (см. рис. 3). В связи с высокой частотой формирования и длительным персистированием у пациента популяции резистентных вариантов вируса после неудачной терапии у врача могут возникать серьезные трудности при планировании повторного курса лечения для больных ХГС именно из такой когорты.
Конкретные схемы, которые могут рассматриваться в нашей стране для назначения повторного курса лечения пациентам с ВГС субтипа 1b, ранее не ответившим на тот или иной вариант терапии, приведены в табл. 2.
Софосбувир + симепревир (SOF + SMV)
Эффективность комбинации нуклеозидного ингибитора полимеразы SOF с ингибитором вирусной протеазы SMV у больных ХГС, вызванным ВГС генотипа 1, с неудачей предыдущей ПВТ, оценена в нескольких клинических исследованиях.
В исследовании IIa фазы COSMOS [10] 167 больных ХГС получали SOF (400 мг 1 раз в день) и SMV (150 мг 1 раз в день) с RBV или без него в течение 12 или 24 недель. Более 3/4 участников этого исследования составили пациенты с нулевым ответом на терапию ПегИФН с RBV. В целом частота УВО через 12 недель после окончания ПВТ (УВО12) составила 92% [90% – у больных с начальным фиброзом (F0–2 по METAVIR) и 94% – у больных с тяжелым фиброзом печени (F3–4 по METAVIR)].
В исследовании фазы III OPTIMIST-1 [11] у пациентов, не имевших признаков цирроза печени, с неудачным опытом лечения ПегИФН с RBV, частота УВО12 после 12-недельного курса терапии SOF с SMV составила 95% (38 человек из 40).
У больных с циррозом печени и опытом лечения (исследование III фазы OPTIMIST-2), эффективность аналогичного курса ПВТ оказалась существенно ниже – 79% (42 человека из 53).
Интересно, что у лиц с субтипом ВГС 1а без цирроза печени и исходным полиморфизмом Q80K эффективность ПВТ была сходна с наблюдаемой у пациентов без мутации Q80K (96 и 97% соответственно). А в популяции пациентов с циррозом, инфицированных ВГС генотипа 1а частота УВО у лиц, имеющих мутацию Q80K, была ниже, чем у больных без варианта Q80K (74 и 92% соответственно).

Учитывая полученные данные, очевидно, что для ранее получавших ПВТ больных ХГС с циррозом печени и ВГС генотипа 1a, при наличии у них полиморфизма Q80K, следует выбирать другой режим лечения. Если мутация Q80K не обнаружена, можно использовать 24-недельный режим ПВТ SOF с SMV [10–12].
В реальной клинической практике частота УВО12 в результате 12 недельного лечения SOF с SMV (с добавлением RBV или без него) составила 86% у больных, ранее получавших ПегИФН с RBV, и 87% – у лиц, имеющих неудачный опыт терапии ПегИФН и RBV в сочетании с ингибитором вирусной протеазы [13].
Софосбувир + даклатасвир (SOF + DCV)
Эффективность 24-недельного курса терапии SOF и DCV (с добавлением RBV или без него) у пациентов без цирроза печени, инфицированных вирусом генотипа 1, ранее не ответивших на лечение ПегИФН и RBV в сочетании с ингибитором протеазы первой волны (TVR или ВОС) оценена в открытом исследовании [14]. Все участники исследования (21 человек), получавшее SOF и DCV, достигли УВО12. В группе лиц, получавших указанную комбинацию в сочетании с RBV, УВО12 отмечен у 19 (95%) из 20 участников. У одного пациента этой группы данные через 12 недель после окончания ПВТ не были получены, однако при дальнейшем наблюдении у него отмечен УВО24.
Благодаря Европейской благотворительной программе раннего доступа, получен опыт применения SOF и DCV у больных ХГС с тяжелым поражением печени. В течение 24 недель терапию этой комбинацией (с добавлением RBV или без него) проводили 485 пациентам (в том числе 337 инфицированным ВГС генотипа 1). Из всех участников Программы 389 (80%) имели цирроз печени; 341 (70%) в прошлом получали ПВТ: 60 (12%) человек – с ингибиторами протеазы, 6 (1%) – включающую SOF.
В целом у больных с ВГС генотипа 1 (за исключением пациентов, выбывших из последующего наблюдения или отозвавших информированное согласие) частота УВО12 после курса терапии SOF и DCV составила 92%, а у получавших данную комбинацию в сочетании с RBV – 91%. Эффективность лечения у пациентов с ВГС субтипа 1b оказалась ниже, чем у участников, инфицированных ВГС субтипа 1а, независимо от наличия в схеме RBV: при терапии без RBV – 89 и 96% соответственно, при добавлении в схему RBV – 90 и 96% [15].
Даклатасвир + асунапревир (DCV + ASV)
На популяции больных, инфицированных ВГС генотипа 1, из 18 стран Европы, Азии, Северной и Южной Америки было проведено крупное многокогортное исследование III фазы HALLMARK-DUAL, в котором из 747 участников 205 человек имели в анамнезе неудачный опыт лечения ПегИФН с RBV [16].
В результате 24-недельной терапии ASV (по 100 мг 2 раза в сутки) с DCV (60 мг 1 раз в сутки) УВО12 достигли 168 (82%) из них.
При планировании лечения больного ХГС комбинацией ASV и DCV целесообразно исходно уточнить наличие у вируса мутаций устойчивости (особенно в регионе NS5A). Как было показано, мутации в этом регионе (L31 и/или Y93) снижают эффективность применения данной схемы, в том числе у больных, ранее не ответивших на ПВТ ПегИФН с RBV. В группе таких больных из 21 пациента европеоидной расы с указанными вариантами мутаций устойчивости (или их сочетанием) лишь 6 (29%) достигли УВО12 в результате терапии ASV и DCV. При этом отсутствие мутаций в регионе NS5A позволяет получить хороший результат: из 145 пациентов данной категории, не имевших резистентности, у 135 (92%) лечение оказалось успешным.
Уменьшить негативное влияние вирусной резистентности на эффективность лечения ASV и DCV, вероятно, могло бы добавление RBV. В исследованиях III фазы действенность такого подхода не изучали. Тем не менее, группа исследователей из Тайваня недавно представила результаты своего пилотного исследования, подтверждающие, что добавление RBV (даже в низкой дозе) к ASV и DCV может улучшать ответ на терапию у больных ХГС с наличием мутаций устойчивости в регионе NS5A вируса [17]. Согласно данным авторов, 6 взрослых пациентов, инфицированных ВГС генотипа 1b, имевших полиморфизм NS5A-Y93H (> 20%), в течение 24 недель вместе с ASV и DCV получали RBV (800 мг в сутки). В результате 5 (83%) из них достигли УВО12, у одного пациента (с циррозом печени) был зафиксирован вирусологический прорыв на 24-й неделе лечения. Обнадеживающие результаты этого исследования и возможное снижение затрат на ПВТ в условиях ограниченных ресурсов (учитывая низкую стоимость RBV) доказывают целесообразность дальнейшего изучения такого терапевтического подхода.
В связи с тем, что ASV и DCV метаболизируются преимущественно через печень, применение данной комбинации безопасно у больных с нарушением функций почек, в том числе находящихся на программном гемодиализе [18].
Паритапревир/ритонавир/омбитасвир + дасабувир (PTV/r/OBV + DSV)
Комбинацию из трех ПППД, обычно называемую 3D-терапией, образуют ингибитор протеазы PTV, который для улучшения фармакокинетических свойств бустируется RTV, NS5A-ингибитор OBV и ненуклеозидный ингибитор полимеразы DSV. Указанные препараты применяются в фиксированных дозах: PTV (150 мг), RTV (100 мг), OBV (25 мг) – 1 раз в сутки, DSV (250 мг) – 2 раза в сутки.
Эффективность и безопасность этой схемы ПВТ, иногда условно обозначаемой как «PrOD», хорошо изучена в клинических исследованиях с тысячами участников, включая больных ХГС, инфицированных ВГС генотипа 1, имеющих в анамнезе неудачный опыт ПВТ.
В исследовании III фазы MALACHITE-II из 101 пациента с ВГС генотипа 1 (в основном, с начальным или умеренным фиброзом печени) и неудачным опытом ПВТ ПегИФН с RBV УВО12 после курса 3D-терапии достигли 100 (99%) человек [19].
По данным исследований III фазы SAPPHIRE-I, -II; PEARL-II, -III [20], у больных с ВГС субтипа 1b без цирроза печени, ранее не ответивших на лечение ПегИФН с RBV, после 12 недель терапии PrOD УВО12 отмечен в 100% случаев, а у пациентов, получавших данную комбинацию в сочетании с RBV, эффективность составила 97%.
В исследовании TURQUOISE-II пациенты с компенсированным циррозом печени получали PrOD и RBV в течение 12 или 24 недель. 220 из 380 участников ранее потерпели неудачу в результате ПВТ ПегИФН с RBV. В целом среди пациентов с опытом лечения (без учета субтипа вируса) УВО12 был достигнут у 90% (110 из 122) после 12-недельной и у 97% (95 из 98) – после 24-недельной терапии. Дальнейший анализ показал, что наибольший вклад в снижение частоты УВО при 12-недельном курсе внесли пациенты с субтипом 1а. Было установлено, что нулевой ответ на ПВТ ПегИФН с RBV у лиц, инфицированных ВГС субтипа 1а, ассоциируется с меньшей вероятностью достижения УВО при 12-недельной продолжительности лечения, поэтому оптимальная продолжительность терапии для больных с вирусом генотипа 1а и циррозом печени составляет 24 недели. У пациентов с ВГС субтипа 1b 12 недель 3D-терапии с RBV оказалось вполне достаточно. Эффективность такого лечения составила 97%.
В открытом исследовании IIIb фазы TURQUOISE-III [21] было показано, что у больных с ВГС субтипа 1b и компенсированным циррозом печени отсутствует необходимость добавлять к PrOD RBV. Все 60 участников исследования, более половины из которых ранее не ответили на ПВТ ПегИФН с RBV, достигли УВО12 в результате 12-недельной 3D-терапии без RBV.
Данные о целесообразности применения PrOD у пациентов, ранее не ответивших на трехкомпонентную терапию ПегИФН, RBV и ингибитором вирусной протеазы (TVR, BOC или SMV), противоречивы. С одной стороны, EASL и AASLD не относят эту комбинацию к числу рекомендованных для «перелечивания» больных указанной категории, с другой – имеются факты, указывающие, что такой подход может быть эффективным.
В результате анализа данных 5 исследований III фазы установлено, что у пациентов с ВГС GT1b исходное наличие мутаций устойчивости не влияет на эффективность 3D-терапии [22].
Реальная клиническая практика подтверждает, что курс лечения PrOD у пациентов, ранее получавших ПегИФН и RBV с ингибитором протеазы первой волны, позволяет достигать желаемых результатов. 96% больных ХГС с неудачей предыдущей ПВТ ПегИФН, RBV и TVR или BOC (48 из 50 пациентов в Венгрии, 46 из 48 – в Германии), достигли УВО после применения 3D-терапии вкачестве повторного курса лечения [23, 24].
Рекомендации экспертов EASL для пациентов с тяжелым фиброзом печени (F3–4 по METAVIR), не ответивших на применение схем терапии, включающих SOF, продлевать курс PrOD до 24 недель и добавлять к указанной комбинации RBV, очевидно, нуждаются в уточнении. По нашему мнению, для больных, инфицированных ВГС субтипа 1b, удвоение продолжительности курса лечения нецелесообразно, поскольку при значительном увеличении стоимости вряд ли может существенно повысить эффективность терапии.
Комбинации для «перелечивания» больных с ВГС генотипа 1, не ответивших на схемы терапии, содержащие ингибитор-NS5A
Пациенты, которые не достигли УВО после курса ПВТ, содержавшего NS5A-ингибитор (DCV, OBV и др.), являются, пожалуй, наиболее сложной для повторного лечения категорией больных в связи с высокой вероятностью наличия у них крупной популяции NS5A-резистентных вариантов вируса.
Для таких больных пока могут быть предложены только 2 схемы ПВТ, состоящие из зарегистрированных в нашей стране ПППД:
- SOF + DCV + SMV.
- SOF + PTV/r /OBV + DSV.
К обеим комбинациям нужно добавлять RBV. Продолжительность лечения для пациентов с ВГС субтипа 1b и фиброзом F0–2 по METAVIR составляет 12 недель, для пациентов с ВГС субтипа 1а и/или тяжелым фиброзом (F3–4 по METAVIR) – 24 недели.
Данные об эффективности такого подхода пока весьма скудные.
В исследовании II фазы QUARTZ-I из 22 участников 14 ранее уже получали PrOD, еще 2 – ту же комбинацию, но без DSV. 20 человек были инфицированы ВГС субтипа 1а, 6 имели цирроз печени. Пациенты получали SOF + PrOD ± RBV в течение 12 или 24 недель (в зависимости от субтипа вируса, наличия цирроза и ответа на терапию). 17 из 22 участников исходно имели ≥ 1 мутации устойчивости в одном из 3 регионов вируса. В результате 14 из 15 пациентов, получавших 12-недельную терапию, достигли УВО [25].
Данных из реальной клинической практики пока также очень мало. В многоцентровом проспективном когортном исследовании [7] 3 из 3 больных ХГС, ранее не ответивших на ПВТ SOF с ледипасвиром (LDV) или DCV, достигли УВО12 в результате 12 или 24-недельной терапии SOF с SMV ± RBV.
Целесообразность добавления DCV к SOF и SMV для «перелечивания» пациентов, ранее не ответивших на применение схем, включающих NS5A, по нашему мнению, требует уточнения.
Вероятно, оптимизировать схему повторного лечения таких пациентов может помочь исходное тестирование на наличие у вируса лекарственной устойчивости. В то же время, учитывая ограниченность качественных данных об альтернативных терапевтических возможностях, при отсутствии показаний для срочного лечения, возможно, более правильным будет воздержаться от «перелечивания» таких больных до появления вариантов ПВТ с высокой и хорошо доказанной эффективностью.
Современные возможности повторного лечения больных, инфицированных ВГС генотипов 2 и 3
Для больных ХГС, инфицированных ВГС генотипов 2 или 3, пока единственной комбинацией, состоящей из зарегистрированных в Российской Федерации ПППД, является сочетание SOF и DCV. Этот вариант может применяться для повторного лечения пациентов, ранее не ответивших на следующие курсы ПВТ: ПегИФН + RBV; ПегИФН + RBV + SOF; SOF ± RBV. «Перелечивание» SOF, DCV и RBV лиц с начальным или умеренным фиброзом печени проводят в течение 12 недель, больных с тяжелым фиброзом (F3–4 по METAVIR) – в течение 24 недель. Для пациентов, инфицированных ВГС генотипа 2, ранее не ответивших на ПегИФН с RBV, может быть выбран «облегченный» вариант терапии SOF с DCV (без добавления RBV) продолжительностью 12 недель.
Эффективность применения комбинации SOF + DCV ± RBV у не леченных ранее больных ХГС с ВГС генотипа 2 изучена неплохо, но у пациентов, имеющих в анамнезе неудачный опыт ПВТ, нуждается в дальнейшем изучении.
Опыт «перелечивания» SOF с DCV больных, инфицированных ВГС генотипа 3, не ответивших на варианты ПВТ, включающие ИФН, несколько более обширный.
В исследовании ALLY-3 [26] УВО12 в результате 12-недельной терапии SOF (400 мг в сутки) и DCV (60 мг в сутки) достигли 32 из 34 пациентов без цирроза, но лишь 9 из 13 пациентов с циррозом печени.
Необходимость добавления RBV к SOF и DCV была показана в исследовании ALLY-3+ [27], в котором у участников с циррозом печени и неудачным опытом ПВТ, получавших SOF + DCV + RBV, отмечена существенно более высокая эффективность лечения. УВО12 после 12-недельного курса достигли 14 из 16 пациентов, после 16-недельного – 12 из 14.
Целесообразность увеличения продолжительности лечения до 24 недель нуждается в дополнительном обосновании. Несомненно, однако, что такой подход может рассматриваться для «перелечивания» пациентов, имеющих противопоказания к приему RBV.
В Европейской благотворительной программе раннего доступа больные ХГС с тяжелым поражением печени получали SOF (400 мг в сутки) с DCV (60 в мг в сутки) в течение 24 недель (с добавлением RBV или без него). В результате УВО12 достигли 47 (84%) из 56 участников программы с неудачным опытом ПВТ, инфицированных ВГС генотипа 3 (независимо от наличия в схеме RBV) [15].
Перспективы повторного лечения больных хроническим гепатитом С
В свете появления новых препаратов и схем ПВТ перспективы лечения больных ХГС (в том числе имеющих неудачный опыт терапии в анамнезе) выглядят обнадеживающими. Некоторые новые ПППД и их комбинации, обещающие в ближайшем будущем расширить арсенал российских специалистов, заслуживают отдельного упоминания.
Интересным «инструментом» для «перелечивания» пациентов с ВГС генотипа 1 выглядит зарегистрированный в нашей стране отечественный ингибитор вирусной протеазы нарлапревир. Несмотря на то, что этот препарат (как и большинство ингибиторов протеазы) имеет промежуточный барьер к резистентности, он обладает особым (существенно отличающимся от других препаратов своего класса) профилем резистентности. Некоторые распространенные мутации устойчивости в регионе NS3/4A-протеазы ВГС (F43L, V55A, Y56H, Q80K/R, S122R, D168A/E/F/G/H/I/K/L/N/T/V/Y), существенно снижающие ингибирующее влияние на вирус других препаратов этого класса, не оказывают значимого влияния на эффективность действия нарлапревира [28]. В связи с этим применение его в комбинации с другими ПППД (например, с SOF или DCV) у пациентов с известным профилем резистентности может оказаться весьма успешным. Надеемся, что планируемые клинические исследования подтвердят данное предположение.
Неплохую эффективность при «перелечивании» больных ХГС с вирусом генотипа 1 демонстрирует комбинация ингибитора NS3/4A-протеазы 2-го поколения GZR с новым ингибитором-NS5A EBR. Более высокий по сравнению с большинством препаратов этого класса генетический барьер GZR позволяет этой комбинации сохранять активность в отношении вариантов ВГС, устойчивых к действию многих других ингибиторов протеазы [29, 30].
В рандомизированном открытом исследовании III фазы C-EDGE TE пациенты, ранее не ответившие на терапию ПегИФН с RBV, получали GZR (100 мг в сутки) и EBR (50 мг в сутки) ± RBV (дозированный по массе тела) в течение 12 или 16 недель. Более трети участников исследования имели цирроз печени, 90% были инфицированы ВГС генотипа 1 (остальные – ВГС генотипов 4 или 6), 5% имели ко-инфекцию ВИЧ.
В результате 12-недельной терапии GZR/EBR УВО12 достигли 90 (94%) из 96 больных, инфицированных ВГС генотипа 1 (с субтипом 1а – 90%, с субтипом 1b –100%). Выраженность фиброза печени не оказывала влияния на эффективность лечения: частота УВО12 составила 94% у пациентов как с циррозом печени, так и без него.
После 16-недельной терапии GZR/EBR + RBV УВО12 достигли 93 (97%) из 96 участников исследования, инфицированных ВГС генотипа 1 (с субтипом 1а – 95%, с субтипом 1b – 100%). У пациентов без цирроза частота УВО12 составила 95%, а у больных с циррозом печени – 100% [31, 32].
Очевидно, что пациентам с ВГС субтипа 1b, ранее не ответившим на терапию ПегИФН с RBV, независимо от наличия цирроза печени, будет достаточно 12-недельного курса GZR/EBR без добавления RBV.
Эффективность применения комбинации у больных ХГС, инфицированных вирусом генотипа 1, ранее не ответивших на лечение ПегИФН и RBV в сочетании с ингибитором протеазы (TVR, BOC или SMV), оценивали в открытом исследовании II фазы C-SALVAGE. 79 его участников (включая 34 пациентов с циррозом печени) в течение 12 недель получали GZR (100 мг в сутки) / EBR (50 мг в сутки) + RBV (800–1400 мг в сутки). В результате УВО12 достигли 76 (96%) из 79 пациентов (с субтипом 1а – 93%, с субтипом 1b – 98%). Наличие цирроза печени показатели эффективности ПВТ ухудшало незначительно: у пациентов с циррозом печени частота УВО12 составила 94%, у пациентов без цирроза – и 98%.
У 44% участников этого исследования исходно были выявлены различные мутации устойчивости (или их сочетание) в регионе NS3/4A-протеазы и/или NS5A. Резистентность оказывала определенное влияние на эффективность данного варианта лечения. У пациентов без исходно выявленной резистентности частота УВО12 составила 100%. У больные, у которых до начала терапии были выявлены мутации устойчивости только в регионе NS3/4A-протеазы, частота УВО12 составила 91%. Более значимо эффективность терапии была снижена у пациентов с наличием NS5A или двойных (NS5A + NS3/4А) резистентных вариантов вируса. У них УВО12 отмечен в 75 и 67% случаев соответственно [33].
В связи с этим больным ХГС с вирусом генотипа 1 и мутациями устойчивости в регионе NS5A (а, возможно, и всем пациентам, ранее не ответившим на NS5A-содержащие схемы терапии), следует предлагать продленную (16-недельную) схему терапии GZR/EBR + RBV или еще более усиленные варианты лечения. Также более мощные комбинации необходимы для «перелечивания» больных ХГС с резистентными вариантами вируса, имеющего мутации устойчивости сразу в двух регионах (NS3/4А и NS5A).
Такая комбинация, позволяющая преодолеть сложные варианты резистентности, может быть составлена путем добавления к GZR/EBR SOF и RBV. В исследовании II фазы C-SWIFT (часть В) после 12-недельной терапии по схеме GZR/EBR + SOF + RBV УВО12 отмечен у всех 3 участников с ВГС генотипа 1, имевших двойные (NS3/4А + NS5A) мутации устойчивости [34].
В открытом исследовании C-ISLE [35] у больных ХГС с компенсированным циррозом печени, инфицированных вирусом генотипа 3 и имеющих неудачный опыт лечения ПегИФН с RBV (исключая лиц, прекративших лечение по причинам, не связанным с исследуемыми препаратами), УВО был отмечен у всех пациентов, прошедших полный (12 или 16-недельный) курс терапии по схеме GZR/EBR + SOF ± RBV. Наличие мутаций устойчивости в регионе NS5A, а также продолжительность курса лечения и присутствие в схеме RBV не оказывало значимого влияния на эффективность терапии.
Перспективной в плане повторного лечения представляется пангенотипическая комбинация, образованная сочетанием SOF с новым NS5A-ингибитором велпатасвиром (VEL). Эффективность ее применения, в том числе у больных, не ответивших на первичный курс ПВТ, оценена в нескольких клинических исследованиях.
В двойном слепом плацебо-контролируемом исследовании III фазы ASTRAL-1 [36] больные ХГС, инфицированные вирусом генотипов 1, 2, 4, 5 или 6, получали SOF (400 мг 1 раз в сутки) и VEL (100 мг 1 раз в сутки) в течение 12 недель. Среди больных с ВГС генотипа 1 УВО достигли 50 (98%) пациентов, ранее не ответивших на терапию ПегИФН с RBV, и 48 (100%) пациентов, имеющих неудачный опыт терапии ПегИФН и RBV в сочетании с ингибитором протеазы. У больных с ВГС генотипов 2, 4, 5, или 6, независимо от варианта предшествующей терапии, эффективность комбинации SOF/VEL была абсолютной: частота УВО составила 100%.
Эффективность лечения больных ХГС с вирусом генотипа 3 оцененивали в исследовании III фазы ASTRAL-3 [37]. После 12 недель терапии SOF/VEL только 57 (89%) из 64 больных, ранее не ответивших на терапию ПегИФН с RBV, достигли УВО12. Наличие у больного резистентности в регионе NS5A, очевидно, является ключевым фактором, негативно сказывающимся на эффективности терапии SOF с VEL. В указанном исследовании NS5A-резистентный вариант вируса (Y93H) был обнаружен у 9% обследованных. Частота УВО12 у таких пациентов оказалась существенно ниже, чем у остальных участников исследования (84 и 97% соответственно).
Очевидно, повышению эффективности ПВТ способствует добавление к SOF/VEL RBV. На целесообразность такого подхода указывают результаты исследования II фазы, в котором среди пациентов с ВГС генотипа 3, имевших неудачный опыт терапии на основе ПегИФН, частота УВО12 у лиц, получавших SOF/VEL в сочетании с RBV, была выше [38].
Оценить возможность преодоления резистентности путем пролонгирования терапии по указанной схеме на данный момент проблематично. Данные по «перелечиванию» в течение 24 недель SOF и VEL с добавлением RBV больных ХГС, не ответивших на схемы терапии, включающие NS5A, пока ограничены результатами одного открытого исследования, в котором такую схему ПВТ получали пациенты, не ответившие на ПВТ SOF/VEL (8–12 недель) в рамках исследований II фазы. Из 17 больных с ВГС генотипа 3 УВО12достигли 13 (76%) [39].
Еще одну новую комбинацию, возможность применения которой не зависит от генотипа вируса, составляют ингибитор NS3/4A-протеазы GLE и NS5A-ингибитор PIB. Эффективность лечения этими препаратами оценена в ряде клинических исследований II и III фазы (ENDURANCE-1,2,4; SURVEYOR-2; EXPEDITION-1,4; MAGELLAN-1), в которые были включены почти 2000 больных ХГС. Около 40% участников имели в анамнезе неудачный опыт лечения.
В исследованиях III фазы ENDURANCE-1,-2,-4 больные ХГС без цирроза, инфицированные вирусом генотипов 1, 2, 4, 5 или 6, получали ПВТ GLE (300 мг в сутки) с PIB (120 мг в сутки) в течение 8 или 12 недель. Более 1/3 участников ранее не ответили на лечение ИФН или ПегИФН ± RBV, или SOF + RBV ± ПегИФН. В результате, независимо от продолжительности курса лечения и генотипа ВГС, частота УВО12 составила 99% [40–42].
Пациентов с ВГС генотипа 3 и неудачным опытом терапии ИФН или ПегИФН ± RBV, или SOF + RBV ± ПегИФН (в том числе имеющих компенсированный цирроз печени) «перелечивали» GLE/PIB в течение 12 или 16 недель в рамках исследования II фазы SURVEYOR-2. У больных без цирроза частота УВО12 после 12 и 16 недель ПВТ составила 91% (20 из 22) и 96% (21 из 22) соответственно. Из 47 участников исследования, имевших компенсированный цирроз, после 16 недель лечения GLE/PIB УВО12 достигли 45 (96%) [43].
В открытом исследовании III фазы EXPEDITION-4 [44] больные ХГС с почечной недостаточностью, инфицированные ВГС генотипов 1–6, получали ПВТ стандартными дозами GLE (300 мг в сутки) / PIB (120 мг в сутки) в течение 12 недель. Исходно 82% пациентов находились на программном гемодиализе, 19% имели цирроз печени, 42% ранее получали терапию ИФН или ПегИФН ± RBV, или SOF + RBV ± ПегИФН. В результате из 104 участников исследования УВО12 достигли 102 (98%).
Весьма интересные и обнадеживающие данные получены в открытом исследовании II фазы MAGELLAN-1, в котором больные ХГС без цирроза, инфицированные ВГС генотипа 1, имевшие неудачный опыт терапии ПППД, были «перелечены» по схеме GLE/PIB ± RBV. Более половины участников исследования ранее получали ингибитор NS3/4A-протеазы и/или ингибитор NS5B-полимеразы, примерно 1/3 – ингибитор NS3/4A-протеазы в сочетании с ингибитором NS5A, а 16% – только ингибитор NS5A-репликативного комплекса ВГС. У 82% обследованных исходно выявляли NS3- и/или NS5A-резистентные варианты вируса, составляющие более 1% вирусной популяции, что, однако, существенно не повлияло на эффективность терапии. У пациентов, получавших GLE/PIB по 300/120 мг в сутки с RBV или без него в течение 12 недель, частота УВО12 составила 95% (независимо от наличия в схеме RBV). Чуть более низкая эффективность терапии отмечена у лиц, имевших мутации устойчивости в регионах NS5A и NS3 + NS5A – 90 и 94% соответственно [45].
Благодаря высокому генетическому барьеру PIB комбинация GLE/PIB сохраняет мощную ингибирующую активность в отношении NS5A-резистентных вариантов вируса (в том числе L31M и Y93С/H/N). Эта уникальная особенность, безусловно, особо значима для успеха повторного лечения больных ХГС.
Заключение
Нет сомнений в том, что схемы ПВТ, применяемые для повторного лечения больных, не ответивших на первичный курс терапии, будут постоянно уточняться по мере накопления данных, а возможности терапии продолжат расширяться с появлением новых препаратов. Вместе с тем очевидно, что основные принципы, которыми необходимо руководствоваться в ближайшей перспективе для достижения максимального результата, останутся неизменными.
Преодолению вирусной резистентности и повышению эффективности повторного курса ПВТ способствуют следующие мероприятия:
- комбинирование ПППД разных классов;
- использование препаратов с высоким генетическим барьером;
- замена класса ПППД;
- добавление RBV в схему терапии;
- увеличение продолжительности курса лечения;
- комбинирование ПППД с ПегИФН.
Все эти принципы должны применяться к конкретному больному ХГС с учетом его индивидуальных особенностей.
Определение не только генотипа и субтипа ВГС, стадии фиброза печени, но и исследование профиля резистентности перед проведением повторного курса ПВТ должны стать рутинной клинической практикой. Лишь учитывая эти важные данные, а также принимая в расчет наличие у больного опыта ПВТ и имеющиеся сопутствующие заболевания, можно выбрать для него оптимальный режим «перелечивания».
Больные ХГС, имеющие в анамнезе неудачный опыт лечения (особенно с ПППД), являются одной из наиболее сложных категорий пациентов. Цена ошибки при проведении повторного курса ПВТ может быть очень высока. Только используя самые современные знания о болезни и весь свой опыт, врач, подобно грамотному лоцману, проводящему судно по верному фарватеру, в обход подводных рифов, мелей и опасных течений, должен выбирать оптимальный режим повторного курса лечения с учетом всех факторов, которые могут оказать влияние на конечный результат.



