Инфекция мочевыводящих путей (ИМВП) – наиболее частая бактериальная инфекция у детей, которая в последующем может приводить к необратимому паренхиматозному повреждению почек, развитию артериальной гипертензии и хронической почечной недостаточности у взрослых [1]. Прогноз заболевания во многом зависит как от патогенных свойств возбудителей мочевых инфекций, так и от адекватной и своевременной антибактериальной терапии. В последние годы большое значение среди этиологических факторов ИМВП приобретает Enterococcus faecalis [2–5]. Однако до настоящего времени клиническое значение этого микроорганизма в развитии инфекционного процесса и неблагоприятных исходов остается неопределенным из-за постоянно меняющихся свойств, что затрудняет ведение пациентов, особенно с хронической персистирующей и часто рецидивирующей инфекцией [6]. В то же время широкое применение в клинической практике разнообразных антимикробных препаратов привело к формированию антибиотикорезистентности микроорганизмов и тем самым – к изменению их биологических свойств [2]. Своевременно установленный точный диагноз ИМВП, ранняя его диагностика и адекватное этиологическое лечение у детей предотвращают распространение инфекции, снижают риск прогрессирования заболевания и развитие хронической почечной недостаточности [7, 8]. Поэтому изучение особенностей биологических свойств Enterococcus faecalis (в том числе вирулентности, антибиотикорезистентности и др.) является актуальным.
Цель работы – выявление фенотипических особенностей биологических свойств резистентных к антимикробным препаратам E. faecalis, выделенных у детей с ИМВП.
Материалы и методы
В работе исследованы E. faecalis (71 культура), изолированные из мочи детей с ИМВП в возрасте от 3 дней до 18 лет.
Биологические свойства энтерококков изучали классическими микробиологическими методами1. Чувствительность энтерококков к антимикробным препаратам определяли диско-диффузионным методом на среде Мюллера–Хинтона (bioMerieux, Франция), с учетом клинических рекомендаций «Определение чувствительности микроорганизмов к антимикробным препаратам» (2015)2.
Фенотипы резистентности энтерококков оценивали согласно Федеральным клиническим рекомендациям «Принципы организации мониторирования устойчивости ведущих возбудителей инфекций, связанных с оказанием медицинской помощи, к антимикробным препаратам в лечебно-профилактических медицинских организациях здравоохранения» (2014)3.
Для проверки гипотезы о связи различных явлений и признаков и оценки степени взаимосвязи проводился корреляционный анализ Пирсона (R) с расчетом коэффициента корреляции (r) и достоверности корреляции (р). При 0,2
Результаты
В проведенных ранее исследованиях мы установили, что все культуры уропатогенных энтерококков чувствительны только к ванкомицину. Высокая чувствительность E. faecalis была выявлена к фурадонину (94,3 ± 3,2%) и доксициклину (88,7 ± 6,05%). Установлена высокая резистентность энтерококков к эритромицину (75,0 ± 6,0%), тетрациклину (69,8 ± 6,3%), фторхинолонам II и III поколений (ципрофлоксацину – 66,7 ± 6,6%, норфлоксацину – 57,7 ± 6,9%, левофлоксацину – 54,7 ± 6,8%), не используемым в педиатрической практике. Выявлены культуры E. faecalis, резистентные (24,5 ± 6,1%) и с промежуточной чувствительностью (12,2 ± 4,7% культур) к линезолиду. Отмечена обратная корреляция между чувствительностью E. faecalis к линезолиду и возрастом пациента (r = 0,35; р = 0,0409). При этом линезолид у детей раннего возраста с непродолжительным антибактериальным анамнезом используется редко, так как относится к препаратам резерва.
Установлено, что культуры E. faecalis в большей степени резистентны к 3 (14,3% культур) и более антимикробным препаратам (к 4 – 16,3%, к 7 – 10,2%, к 10 – 2,0%). Максимальное количество исследованных культур (20,4%) резистентно к 8 препаратам.
При оценке фенотипа резистентности среди изолятов энтерококков, выделенных у детей при ИМВП, из 4 фенотипов в Приморском крае распространен третий – фенотип «комбинированной» резистентности (резистентность к аминогликозидам и фторхинолонам).
Проведен анализ резистентности энтерококков в зависимости от вида медицинской помощи. Для этого все исследуемые культуры E. faecalis разделили на 2 группы: к 1-й отнесли энтерококки, выделенные от детей с ИМВП, находившихся на стационарном лечении (n = 49); ко 2-й – E. faecalis, изолированные от пациентов, получавших амбулаторную помощь (n = 22). Отмечено, что большинство культур как 1-й, так и 2-й групп чувствительны к фурадонину (93,9 ± 3,4 и 94,4 ± 5,4% соответственно) и доксициклину (89,8 ± 4,3 и 100% соответственно).
Культуры E. faecalis, выделенные от детей, находившихся на амбулаторном лечении, более чувствительны к пенициллину (94,7 ± 5,3%), ампициллину (94,7 ± 5,3%), стрептомицину (78,9 ± 9,6%) и гентамицину (68,4 ± 11%) по сравнению с энтерококками из 1-й группы (64,6 ± 6,8, 62,5 ± 6,9, 65,3 ± 6,8 и 54,1 ± 7,1% соответственно).
E. faecalis обеих групп с одинаковой частотой резистентны к эритромицину (75 ± 6,2 и 84,2 ± 8,6 соответственно) и тетрациклину (71,4 ± 6,5 и 73,6 ± 10,4%), а также к препарату резерва линезолиду (22,3 ± 5,9 и 21,1 ± 9,6%).
По отношению к фторхинолонам у исследуемых изолятов E. faecalis выявлены вариабельные результаты. Энтерококки, выделенные от детей, находящихся на стационарном лечении, обладали более высокой резистентностью к ципрофлоксацину (66 ± 6,8%) и левофлоксацину (53,1 ± 7,1%) по сравнению с энтерококками, изолированными от амбулаторных пациентов (36,8 ± 11,4 и 36,8 ± 11,4% соответственно). К норфлоксацину E. faecalis обеих групп показали практически одинаковую резистентность (54,2 ± 7,1 и 42,1 ± 11,6% соответственно).
Большинство исследуемых культур энтерококков (61,8 ± 5,8%) двух групп обладали полиантибиотикорезистентностью (были резистентны к 4 и более антимикробным препаратам). В то же время культуры E. faecalis, изолированные от пациентов, получающих лечение амбулаторно, чаще были резистентны к 2 или 3 тестируемым антибиотикам (63,1 ± 11,4%). Энтерококки, выделенные от детей, находящихся на стационарном лечении, в 40,8 ± 7,0% случаев были резистентны к 7 и более антимикробным препаратам.
В предыдущих исследованиях [9, 10] были изучены биологические свойства уропатогенных фекальных энтерококков. Используя методы корреляционного анализа, мы установили связь между чувствительностью Е. faecalis к антимикробным препаратам и его биологическими свойствами (см. таблицу). Отмечено, что энтерококки, чувствительные к пенициллинам, обладают in vitro липолитической (в отношении к твин 80), лецитиназной и гемолитической (β-типа) активностью.
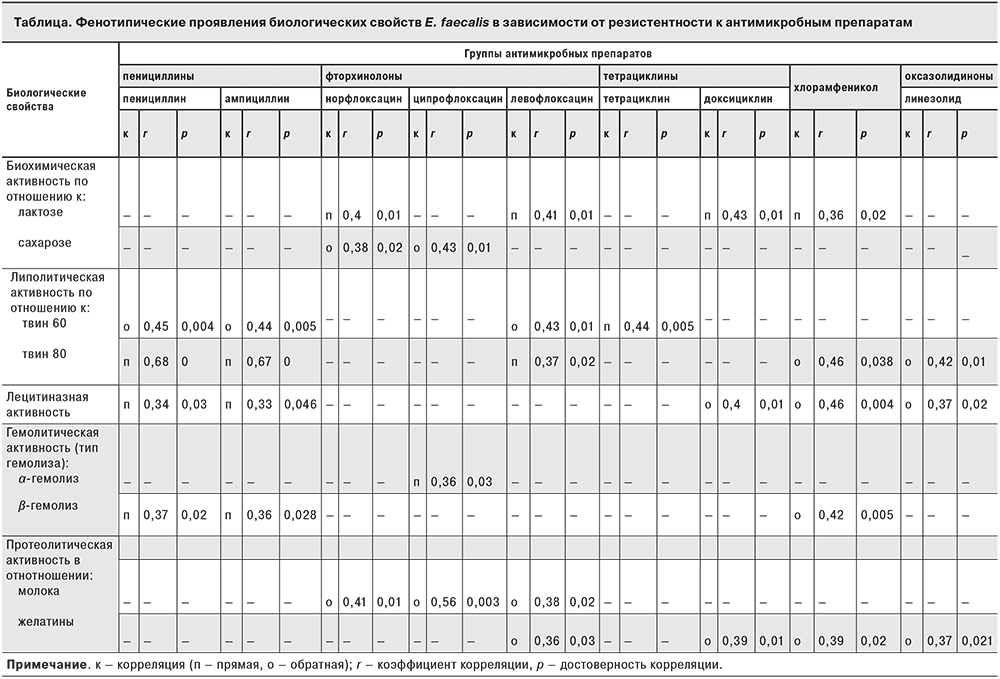
Культуры энтерококков, резистентные к фторхинолонам (препаратам, ингибирующим синтез ДНК), гидролизуют сахарозу, не разлагают лактозу, проявляют протеолитическую активность по отношению к молоку.
Кроме того, было установлено, что уропатогенные энтерококки, обладающие протеолитической активностью, резистентны к антибактериальным препаратам с разным механизмом действия. Например, Е. faecalis с желатиназной активностью резистентны к левофлоксацину (подавляет синтез ДНК), доксициклину (ингибирует синтез белка на субъединице 30S бактериальной рибосомы), хлорамфениколу (ингибирует синтез белка на субъединице 50S бактериальной рибосомы), не применяемым для лечения ИМВП у детей, и препарату резерва линезолиду (подавляет синтез белка в 23S рРНК субъединицы 50S бактериальной рибосомы).
При этом культуры Е. faecalis, резистентные к препаратам, ингибирующим синтез белка на бактериальной рибосоме – гентамицину (обратная корреляция r = 0,33; р = 0,0425) и эритромицину (обратная корреляция r = 0,33; р = 0,041), – имеют капсулу.
Обсуждение
Среди многочисленных факторов, влияющих на развитие ИМВП, приоритетное значение имеют биологические свойства микроорганизмов, колонизирующих почечную ткань. Усиление этиологической роли энтерококка обусловлено многими причинами, в том числе множественной антибиотикорезистентностью [2, 11]. Из антимикробных препаратов в научной литературе описана чувствительность E. faecalis только к гликопептидам, линезолиду, фторхинолонам III и IV поколений, нитрофуранам, отдельным представителям пенициллинов, карбапенемов. Известны промежуточная чувствительность (или ее отсутствие) к хлорамфениколу, линкомицину, тетрациклинам, фторхинолонам II поколения, высоким дозам аминогликозидов в комбинации с пенициллинами [12–14].
Полученные нами результаты в основном согласуются с опубликованными в литературе данными, за исключением 2 препаратов – линезолида (рекомендуемого для лечения инфекций, вызванных штаммами, резистентными к ванкомицину, аминогликозидам и бета-лактамам) и доксициклина, который не используется для лечения ИМВП у детей. При этом отмечена обратная корреляция между чувствительностью E. faecalis к линезолиду и возрастом пациента.
Установлена связь между чувствительностью к антимикробным препаратам культур Е. faecalis с их биологическими свойствами. Выявлено, что уропатогенные энтерококки, обладающие протеолитической активностью, резистентны к антибактериальным препаратам, ингибирующим синтез белка или ДНК.
В современных научных публикациях также отмечена связь антибиотикорезистентности E. faecalis с патогенными факторами. Например, штаммы, резистентные к ампициллину, ципрофлоксацину и гентамицину, но чувствительные к ванкомицину и нитрофурантоину, имеют больше вирулентных факторов (гемолизин, желатиназу, гиалуронидазу, способны к образованию биопленки), чем ванкомицин-резистентные [15–18].
В нашем исследовании E. faecalis, выделенные из мочи детей с ИМВП, установлена связь между полиантибиотикорезистентностью и биологическими свойствами. Важно отметить, что E. faecalis, резистентные к линезолиду и хлорамфениколу (препараты, которые подавляют синтез белка на уровне субъединицы 50S бактериальной рибосомы), по сравнению с другими культурами обладают большим патогенным потенциалом: желатиназной, лецитиназной, липолитической (в отношении твин 80) активностями.
Кроме того, наибольшая антибиотикорезистентность отмечена у штаммов, изолированных из мочи новорожденных детей с ИМВП, наименьшая – у амбулаторных пациентов.
Таким образом, установленный в исследовании комплекс биологических свойств E. faecalis (наличие/отсутствие гемолитической, желатиназной, лецитиназной, липолитической активности) может служить in vitro диагностическим маркером его резистентности к некоторым группам антибактериальных препаратов.



