Инфекции, передаваемые половым путем (ИППП) – одна из серьезных социально-медицинских и психологических проблем современности. Экономические затраты, связанные с диагностикой, лечением, реабилитацией и профилактикой ИППП, определяются также и их осложнениями, такими как воспалительные заболевания органов малого таза, бесплодие, патология и неблагоприятные исходы беременности, патология новорожденных, а также увеличение риска инфицирования ВИЧ [1, 2].
В Российской Федерации во всех возрастно-половых группах населения старше 18 лет на протяжении 2011–2019 гг. снижалась заболеваемость ранними формами сифилиса, трихомонозом, гонококковой и хламидийной инфекцией [3].
В то же время в странах Европейского Союза (по данным ECDC – European Centre for Disease Prevention and Control) и в США (по данным CDC) на протяжении последних лет растет заболеваемость сифилисом, гонококковой и хламидийной инфекцией [4, 5]. При этом общий рост заболеваемости ИППП в мире многие исследователи связывают с увеличением распространения этих инфекций в группах риска, к которым относят мужчин, практикующих секс с мужчинами (МСМ); лиц, оказывающих коммерческие сексуальные услуги (секс-работников – СР) и потребителей психоактивных веществ [6–8].
Кроме того, показатели заболеваемости могут быть связаны с охватом обследованиям на ИППП отдельных групп и населения в целом, а также с особенностями учета и статистики.
Вероятнее всего, официальная статистика не отражает всех случаев ИППП, так как учитывает только лиц, обратившихся за помощью в медицинские учреждения. Обращение за медицинской помощью пациентов из групп, уязвимых в отношении заражения ВИЧ и ИППП, в Российской Федерации затруднено из-за наличия внешней и внутренней стигмы. Кроме того, ИППП могут протекать бессимптомно, особенно при экстрагенитальной локализации, что ограничивает активное обращение пациентов в медицинские учреждения для обследования.
Проблема своевременного выявления и лечения ИППП в группах риска является значимой с точки зрения не только личного здоровья пациента, но и общественного здравоохранения, так как ИППП из уязвимых групп могут передаваться в общую популяцию.
В России профилактический скрининг на ИППП в группах риска не регламентирован, а масштабных исследований по изучению распространенности ИППП в этих группах не проводилось, в связи с чем ситуация по заболеваемости среди таких пациентов остается неизученной. В условиях ограниченных ресурсов (отсутствия единого подхода и четких национальных стандартов проведения скрининга, отсутствия расходных материалов и достаточного количества отечественных диагностических наборов реагентов для его осуществления) ИППП могут стать не только новой серьезной проблемой для клинической медицины. Их распространение имеет важное социально-экономическое значение, так как затрагивает репродуктивное здоровье трудоспособного населения.
Цель исследования – изучение распространенности ИППП, вызванных N. gonorrhoeae, C. trachomatis, M. genitalium, T. Vaginalis и T. pallidum, при обследовании за пределами медицинских учреждений мужчин и женщин из групп риска.
Материалы и методы
Обследование лиц, обратившихся к специалистам фонда «Шаги» и пожелавших пройти обследование на ИППП, проводили с марта по октябрь 2020 г. В нем приняли участие 202 чел., проживающих в Москве и Московской области. Критериями включения служили возраст старше 18 лет, подписанное информированное согласие на участие в исследовании; критерием исключения – отсутствие возможности понять смысл информированного согласия.
Всем пациентам были предложены анкеты для сбора социально-демографических данных и сведений о сексуальном поведении. Если в устной беседе либо в анкете мужчина указывал на половые контакты с мужчинами, его относили к группе МСМ. Также осуществляли отбор в группу СР.
Стратификацию по ВИЧ-статусу проводили на основании данных медицинской документации, предоставленной участником исследования, содержащей положительные результаты обследования на ВИЧ методом иммунного блота. Для лиц, не знающих своего ВИЧ-статуса или не имеющих документально подтвержденных результатов анализов, проводили экспресс-тестирование на выявление специфических антител к ВИЧ.
От каждого участника для последующего ПЦР-тестирования был получен биологический материал из трех анатомических локусов: от мужчин – первичная порция мочи, мазок из ротоглотки и ануса; от женщин – мазок из влагалища, ротоглотки и ануса.
Первичную порцию мочи для определения возбудителей ИППП у мужчин собирали в стерильный одноразовый пластиковый контейнер (ООО «Эрмайнс», Россия), затем, согласно инструкции, перемещали в одноразовую стерильную вакуумную транспортную пробирку для мочи с консервантом (Becton Dickinson, USA).
Взятие соскоба со слизистой оболочки ануса (далее – соскоб из ануса), мазков со слизистых оболочек ротоглотки (далее – мазок из ротоглотки) и влагалища (далее – мазок из влагалища) обследуемые осуществляли самостоятельно с помощью стерильного одноразового зонда (DELTALAB, Испания). Соскобы/мазки помещали в отдельные одноразовые полипропиленовые пробирки с транспортной средой с муколитиком (РУ № ФСР 2009/05514, Центральный НИИ эпидемиологии Роспотребнадзора, Россия, далее – ЦНИИЭ ).
Во всех образцах биологического материала определяли наличие N. gonorrhoeae, C. trachomatis, M. genitalium, T. Vaginalis и T. pallidum методом полимеразной цепной реакции с детекцией флуоресцентного сигнала в режиме реального времени (ПЦР-РВ).
Использовали комплекты реагентов «ДНК-Сорб-АМ» (РУ № ФСР 2007/00183, ЦНИИЭ), «АмплиСенс N. gonorrhoeaeC. trachomatis/M. genitalium/T. vaginalis-МУЛЬТИПРАЙМ-FL» (РУ № ФСР 2009/06060), и «АмплиСенс HSV II/HSV I/T. Pallidum-МУЛЬТИПРАЙМ-FL» (РУ № ФСР 2007/00827) того же производителя. Постановку и анализ результатов амплификации проводили на приборе с системой детекции флуоресцентного сигнала в режиме реального времени Rotor-Gene Q (Qiagen, Германия) в соответствии с инструкцией производителя.
Для статистической обработки данных использовали программный пакет Microsoft Excel (Windows XP) и SPSS16 (допустимая ошибка Е – 5%). Были использованы показатели описательной статистики: средняя (М), медиана (Ме), стандартное отклонение (m), минимум (min), максимум (max), 95% ДИ, IQR.
Результаты
Были обследованы 202 чел. 48 женщин и 154 мужчины. Среди участников исследования преобладали лица молодого возраста 31,58 ± 7,95 года [Ме – 30 лет (18–56); 95% ДИ – 29–33,4 года]. 90 (44,6%) чел. были моложе 30 лет. Характеристика обследованных представлена в табл. 1.
В исследовании в целом преобладали пациенты с высшим образованием (53,5%). Эта тенденция сохранялась среди мужчин (57,8%), а среди женщин большинство имели среднее специальное образование (41,7%).
Все мужчины относились к группе МСМ. ВИЧ-позитивный статус имели 63 (40,9%) чел. (группа МСМ/ВИЧ), 11 из них на момент начала исследования не принимали АРТ. 91 (59,1%) чел. имел ВИЧ-негативный статус (группа МСМ/без ВИЧ). Большинство мужчин, участвовавших в исследовании, имели более 10 половых партнеров за последние 6 мес. (среди МСМ/ВИЧ – 50,8%, среди МСМ/без ВИЧ – 48,4%). У женщин этот показатель составил 87,5%, что неудивительно, так как эта группа была представлена исключительно СР, в то время как среди МСМ/ВИЧ и МСМ/без ВИЧ отнесли себя к СР 12,7 и 28,6% соответственно.
ВИЧ-позитивными были только 3 (6,3%) женщины-СР, которые на момент начала исследовании принимали АРТ. В связи с этим мы объединили женщин-СР с различным ВИЧ-статусом в одну группу для последующего анализа.
Всегда использовали презерватив при анальном сексе 67,5% МСМ, игнорируя использование презервативов при других сексуальных практиках, хотя, согласно данным анкетирования, в этой группе преобладает сочетание орального и анального секса (76,6%). В группе женщин-СР всегда используют презерватив при вагинальном/анальном/оральном сексе 2,1%, а 8,4% женщин – при вагинальном/оральном сексе. Преобладали сочетание вагинального и орального, а также вагинального/орального/анального секса (45,8 и 45,8% соответственно), а частота использования презервативов была намного ниже: всегда использовали презерватив при вагинальном/анальном/оральном сексе 2,1% женщин, при вагинальном/оральном – 8,4%.
При ответе на вопрос «забывали ли Вы использовать презерватив при опьянении (алкогольном или наркотическом)?» выбрали ответ «у меня не бывает наркотического или алкогольного опьянения» только 13% женщин, 6% МСМ/ВИЧ и 9,9% МСМ/без ВИЧ.
Интерес представляют данные о частоте обследования на ИППП в уязвимых группах (табл. 2). Суммарно более половины респондентов каждой группы указали, что проходят обследование на ИППП раз в 6 мес. (29, 41 и 36% соответственно), раз в год (31, 25 и 26%) или только при наличии жалоб (31, 25 и 21%).
При этом причину участия в исследовании как возможность «бесплатно пройти обследование» назвали 75% женщин-СР, 88,9% МСМ/ВИЧ и 83,5% МСМ/без ВИЧ.
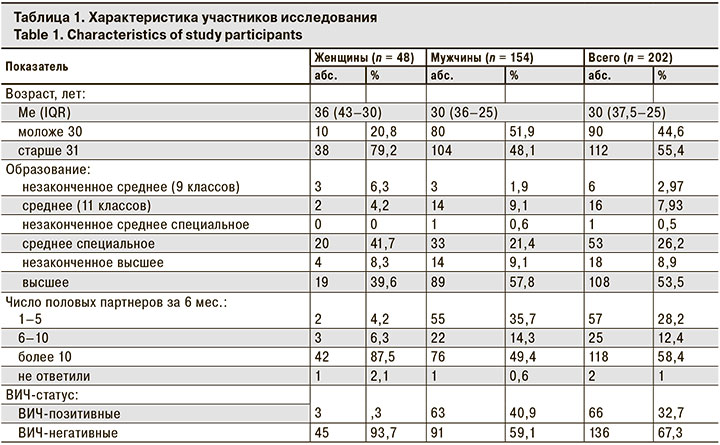
В результате исследования хотя бы 1 возбудитель ИППП (N. gonorrhoeae, C. trachomatis, M. genitalium, T. vaginalis, T. pallidum) был выявлен минимум в 1 из трех анатомических локусов у 43,6% представителей групп риска: у 29,2% женщин-СР, у 54% МСМ/ВИЧ и у 44% МСМ/без ВИЧ. Частота выявления возбудителей ИППП, независимо от анатомического локуса, составила: N. gonorrhoeae – 14,9%, C. trachomatis – 19,3%, M. genitalium – 13,9%, T. pallidum – 4%, T. vaginalis – 1%. Частота выявления возбудителей ИППП в анатомических локусах представлена на рис.1.
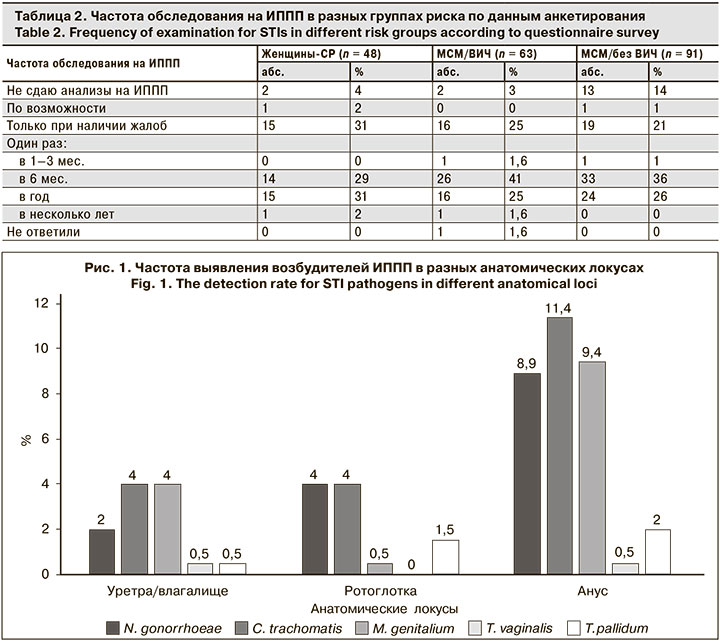
Чаще всего встречалась экстрагенитальная (ректальная и/или орофарингеальная) локализация ИППП – в 70% случаев всех выявленных ИППП, только генитальная – в 7,1% случаев, генитальная в сочетании с экстрагенитальной – в 22,9%.
Формы ИППП в группах различались (рис. 2). Среди МСМ/ВИЧ и МСМ/без ВИЧ чаще встречалась эксрагенитальная форма (ректальная и/или орофарингеальная, 79,4 и 75% соответственно), а в группе женщин-СР – сочетание генитальной и экстрагенитальной форм ИППП (50%).
При экстрагенитальной форме ИППП патологию чаще выявляли изолированно в анусе во всех группах, в ротоглотке – чаще в группе МСМ/без ВИЧ (28%), а сочетание ректальной и орофарингеальной форм – у МСМ/без ВИЧ (19,2%) (рис. 3). Определение возбудителей ИППП в исследованных образцах из трех анатомических локусов показало различие в частоте выявления патологии (табл. 3).

У женщин-СР возбудителей ИППП чаще выявляли в анусе (преимущественно M. genitalium – 8,3%), реже – в ротоглотке. Примечательно, что T. pallidum в этой группе ни разу не был выявлен.
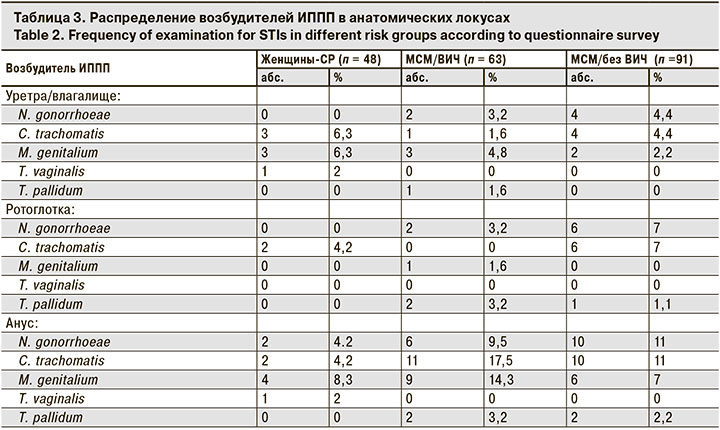
У МСМ возбудителей ИППП тоже чаще выявляли в анусе, но на первом месте у МСМ/ВИЧ находились C. trachomatis и M. genitalium (17,5 и 14,3% соответственно), а у МСМ/без ВИЧ – C. trachomatis и N. gonorrhoeae (по 11%).
Обсуждение
У представителей групп риска во всем мире ИППП выявляются значительно чаще по сравнению с общей популяцией [6, 7].
Частота выявления возбудителей ИППП (N. gonorrhoeae, C. trachomatis, M. genitalium, T. Vaginalis и T. pallidum) у таких пациентов в Московском регионе по результатам тестирования образцов из трех анатомических локусов (уретра/влагалище, ротоглотка и анус) составила 43,6%.
Распространенность ИППП в группах МСМ/ВИЧ, МСМ/без ВИЧ и среди женщин-СР составила 54, 44 и 29,2% соответственно. Полученные данные по МСМ совпадают с результатами исследования Ю.А. Тюленева и соавт. [9], где у 40,3% МСМ в каком-либо из трех анатомических локусов был выявлен хотя бы 1 возбудитель.
В ходе проведенного опроса выявлено, что респонденты из групп ртска часто практикуют секс в состоянии алкогольного и/или наркотического опьянения. Это подтверждают и результаты биоповеденческого исследования, проведенного в 7 городах России, в результате которого установлено, что в Москве почти 60% МСМ имели опыт употребления неинъекционных наркотиков, а в Екатеринбурге и Санкт-Петербурге – до 40% [10], в то время как в Европе этот показатель составил 10% [11].
Особенный интерес представляют данные анкетирования о частоте обследования на ИППП, когда более 50% респондентов каждой группы выбрали такие ответы, как «раз в 6 мес.», «раз в год» и «только при наличии жалоб». Учитывая рискованное поведение представителей уязвимых групп (практикуют секс в состоянии алкогольного и/или наркотического опьянения, не используют презервативвы при каждом половом контакте), частота их обследования представляется недостаточной.
Продемонстрирована высокая частота выявления ректальной и/или орофарингеальной форм ИППП (70%), что в отсутствие рутинной экстрагенитальной диагностики возбудителей приводит к распространению инфекций. Поэтому особенно актуальны рекомендации ряда исследователей о необходимости проведения скрининга на ИППП в уязвимых группах из трех анатомических локусов для выполнения ПЦР [6, 8].
Система скрининга ИППП, основанная на выявлении N. gonorrhoeae, C. trachomatis, M. genitalium, T. vaginalis и T. pallidum методом ПЦР, может быть использована в качестве основы для расширения алгоритма и разработки рекомендаций для выявления ИППП в трех анатомических локусах, в первую очередь у представителей групп риска и за пределами медицинских учреждений.
Выводы
1. Установлена высокая частота встречаемости ИППП (43,6%) у пациентов уязвимых групп при обследовании вне медицинских учреждений.
2. Распространенность возбудителей ИППП среди МСМ/ВИЧ составила 54%, МСМ/без ВИЧ – 44%, в группе женщин-СР – 29,2%.
3. Основными формами ИППП в группах риска являются экстрагенитальные (ректальные и/или орофарингеальные), они сотставляют 70%. Эксрагенитальные формы ИППП преимущественно встречались у МСМ/ВИЧ и МСМ/без ВИЧ (79,4 и 75% соответственно), в группе женщин-СР выявлено сочетание генитальной и экстрагенитальной форм (50%).
4. Частота выявления возбудителей ИППП, независимо от анатомического локуса, составила: C. trachomatis – 19,3%, N. gonorrhoeae – 14,9%, M. genitalium – 13,9%, T. pallidum – 4%, T. vaginalis – 1%.
5. Полученные результаты подтверждают необходимость:
- проведения скрининга ИППП в уязвимых группах из трех анатомических локусов методом ПЦР;
- внесения изменений в протокол обследования пациентов групп риска ввиду преобладания экстрагенитальных форм ИППП (регистрация расходных материалов для взятия образцов соскоба эпителиальных клеток ануса и разработка специализированных тест-систем).
- проведения дополнительного консультирования в группах о возможности заражения ИППП при оральном и анальном сексе, а также по вопросам профилактики и диагностики ИППП, так как отрицательный мазок из уретры/влагалища не гарантирует отсутствия возбудителя в других анатомических локусах.



