По данным ЮНЭДС, общее число больных ВИЧ-инфекцией в Киргизской Республике в 2018 г. составляло примерно 8500 человек (6500–12 000) [1]. Предыдущее исследование образцов, собранных в 2009–2010 гг. от 57 пациентов без опыта терапии, выявило, что 45,6 и 40,4% из них содержали соответственно вирусы генетических вариантов CRF02_AG и A1 (вариант IDU-A). Кроме того, около 7% исследованных образцов ВИЧ-1 имели мутации устойчивости к препаратам классов НИОТ и ННИОТ [2].
Однако с 2015 г. номенклатура ВИЧ-1 и методика интерпретации результатов генотипирования (в том числе алгоритм автоматического определения генотипа в онлайн приложениях) были значительным образом пересмотрены. В частности, генетическому варианту, именуемому ранее IDU-A (FSU-A), было присвоено наименование «суб-субтипа A6» [3, 4]. Кроме того, детально описанный в 2014 г. рекомбинантный вариант CRF63_02A1 [5] был выявлен в образцах ВИЧ-1 из России, в том числе у пациентов, вирус в организме которых ранее был интерпретирован как CRF02_AG [6]. Более того, недавнее исследование позволило установить наиболее вероятное место и время генерации CRF63_02A1 – Узбекистан, примерно 1996 г. [7]. Это может служить объяснением активного распространения данного варианта в странах Средней Азии.
Таким образом, существует необходимость в актуализации информации о циркуляции генетических вариантов ВИЧ-1 в Киргизии с учетом всех накопленных знаний об их особенностях.
Помимо Бишкека, столицы Киргизии, вторым городом республиканского значения является Ош, административный центр Ошской области. Ошская область находится в Ферганской долине и ввиду своего географического положения граничит одновременно с тремя государствами региона: Таджикистаном, Узбекистаном и Китаем. Это исторически ставило область в исключительное экономическое положение, делая ее частью крупнейших торговых маршрутов. Таким образом, экономическое и политическое влияние Оша исторически велико. В частности, в 1962–1970 гг. в состав Ошской области Киргизской АССР входила территория современных Джалал-Абадской и Баткенской областей [8], так что Ошская область занимала почти половину территории страны. К несчастью, наряду с торговыми потоками через Ошскую область проходит один из основных путей наркотрафика из Таджикистана в Казахстан и Россию [2, 9]. Проведенное ранее исследование генетических вариантов ВИЧ-1 в образцах из различных административных центров Казахстана [9] и России [6] показало, что распределение вариантов ВИЧ-1 в отдельных регионах каждой страны может сильно отличаться от общей статистики по стране в целом. Во многом это объясняется географическим положением данных административных центров, их взаимодействием с соседними государствами и национальным составом проживающего на территории населения.
По этой причине при изучении распространения ВИЧ-инфекции в Киргизии стоит обращать внимание на возможные особенности эпидемии в разных регионах страны. Ранее при сравнении вариантов ВИЧ-1, циркулировавших на территории соседних Чуйской и Джалал-Абадской областей, была отмечена экстремально высокая частота выявления уникальных рекомбинантных AG-форм в Джалал-Абадской области (41,8%) по сравнению с Чуйской областью (3,7%) [10].
В рамках осуществления глобальной стратегии ВОЗ «90-90-90» [11] в Киргизии широко применяется антиретровирусная терапия (АРТ). Так, в 2018 г. ее получали 3710 граждан Республики [1]. Расширение применения терапии диктует необходимость исследования ВИЧ-1 у пациентов с опытом лечения, в том числе у лиц, испытавших вирусологическую неудачу. Такие исследования необходимы как для оценки приобретенной лекарственной устойчивости (ADR – от англ. acquired drug resistance) [12], так и для прогнозирования эффективности терапевтических мероприятий в стране в целом.
Целью настоящего исследования было проведение молекулярно-генетического анализа образцов от пациентов из Киргизской Республики, испытавших вирусологическую неудачу АРТ.
Материалы и методы
Была собрана коллекция образцов плазмы крови от граждан Киргизской Республики. Образцы исследовали с помощью набора «АмплиСенс HIV-Resist-Seq» (Россия). Были получены нуклеотидные последовательности региона pol (позиции 2253–3368 референсного штамма HXB-2, номер GenBank K03455), кодирующего протеазу, и фрагмент обратной транскриптазы ВИЧ-1.
Секвенирование очищенных фрагментов ДНК проводили с помощью генетического анализатора Applied Biosystems (LifeTechnologies, США) в соответствии с инструкцией производителя. Обработку данных секвенирования и получение консенсусной нуклеотидной последовательности осуществляли с помощью программного обеспечения «ДЕОНА» (версия 1.2.3). Предварительное определение генотипа проводили с помощью онлайн приложений REGA HIV-1 Subtyping Tool v3.0 [13] и COMET HIV-1 v2.2 [14]. Выравнивание нуклеотидных последовательностей и филогенетический анализ проводили в программе MEGA 6.0 [15]. Для образцов, давших неоднозначный/сомнительный результат онлайн генотипирования и/или филогенетического анализа, проводили дополнительный анализ в приложении HIV BLAST сайта международной базы данных института Лос-Аламос (США) [16].
Для анализа основных мутаций лекарственной устойчивости (ЛУ) ВИЧ-1 использовали базу данных Стэнфордского университета HIVdb v8.4. [17]. Помимо этого был определен уровень ЛУ на основании баллов (drug penalty score), присвоенных каждой выявленной мутации резистентности или комбинации мутаций и характеризующих частоту ассоциаций мутаций с резистентностью ВИЧ-1 к препаратам.
Для оценки статистической достоверности различий исследуемых признаков для различных выборок применяли критерий согласия Пирсона (χ2) [18]. Различия считались достоверными при p < 0,05.
Результаты
Была проанализирована коллекция из 100 образцов плазмы крови, собранная в 2017–2018 гг. от пациентов из г. Бишкек и Чуйской области (n = 57), а также областей Ошской (n = 31), Иссык-Кульской (n = 9), Нарынской (n = 2) и Таласской (n = 1). От женщин было получено 45 образцов. Возраст пациентов варьировал от 5 до 66 лет, составив в среднем 36 лет. Основными путями инфицирования для пациентов были гетеросексуальные контакты (n = 49) и потребление инъекционных наркотиков (ПИН) (n = 31), а также парентеральное вмешательство и заражение в медучреждениях (n = 16), вертикальная передача (n = 2) и гомосексуальные половые контакты (МСМ) (n = 2).
Была выявлена связь пути инфицирования с полом пациента: 31 из 49 образцов, полученных от пациентов с гетеросексуальным путем инфицирования, принадлежал женщинам, в то время как 27 из 31 пациента группы ПИН были мужчинами (p < 0,001). Также была выявлена некоторая закономерность в принадлежности к уязвимой группе по территориальному признаку: 25 (43,9%) пациентов из Чуйской области относились к ПИН, в то время как к этой группе относились только 4 (12,9%) жителя Ошской области (p = 0,004).
Наиболее распространенными схемами первой линии терапии у пациентов были комбинации TDF/FTC/EFV (n = 52) и AZT(PhAZT)/3TC/EFV (n = 23). Высокая приверженность терапии была характерна для 48 пациентов.
Тем не менее на вторую линию терапии были переведены 40 пациентов, 21 из которых имел высокую приверженность АВТ первой линии, но испытал вирусологический неуспех или столкнулся с побочными явлениями и/или отсутствием препаратов. Второй линии терапии были высоко привержены 25 (62,5%) пациентов.
Наконец, вирусологическую неудачу после применения трех схем терапии на момент забора испытали 13 пациентов, 5 (38,46%) из которых имели высокую приверженность последней схеме.
Следует отметить, что в состав второй и третьей линии терапии входили преимущественно сочетания препаратов из комбинаций, описанных выше и ранее пациентом не принимаемых.
Самая рискованная в отношении развития ЛУ группа – пациенты с умеренной приверженностью, то есть принимающие 70–95% прописанных медикаментов, в организме которых создается концентрация препаратов, оптимальная для селекции ЛУ. В исследуемой группе умеренная приверженность любой из линий терапии была отмечена у 39 пациентов.
Генетическая характеристика вариантов ВИЧ-1 в исследованной коллекции
Результаты онлайн генотипирования и последующий филогенетический анализ позволили установить, что 56 образцов ВИЧ-1 из 100 относились к рекомбинантной форме CRF63_02A1 (рис. 1), в том числе образец, образовавший внешний кластер с низкой достоверностью (39%) на филогенетическом дереве совместно с образцами и контролями этой генетической формы. К исторически доминирующему на территории СНГ варианту A6 [3] относился 41 образец. Примечательно, что среди образцов из Ошской области доминирующим генетическим вариантом (77,41% образцов) был именно CRF63_02A1. В то же время среди пациентов из г. Бишекек и Чуйской области на долю CRF63 и A6 приходилось 49,12 и 47,37% образцов соответственно. Обнаруженные различия в распространенности CRF63_02A1 в двух областях были статистически достоверны (p = 0,01).
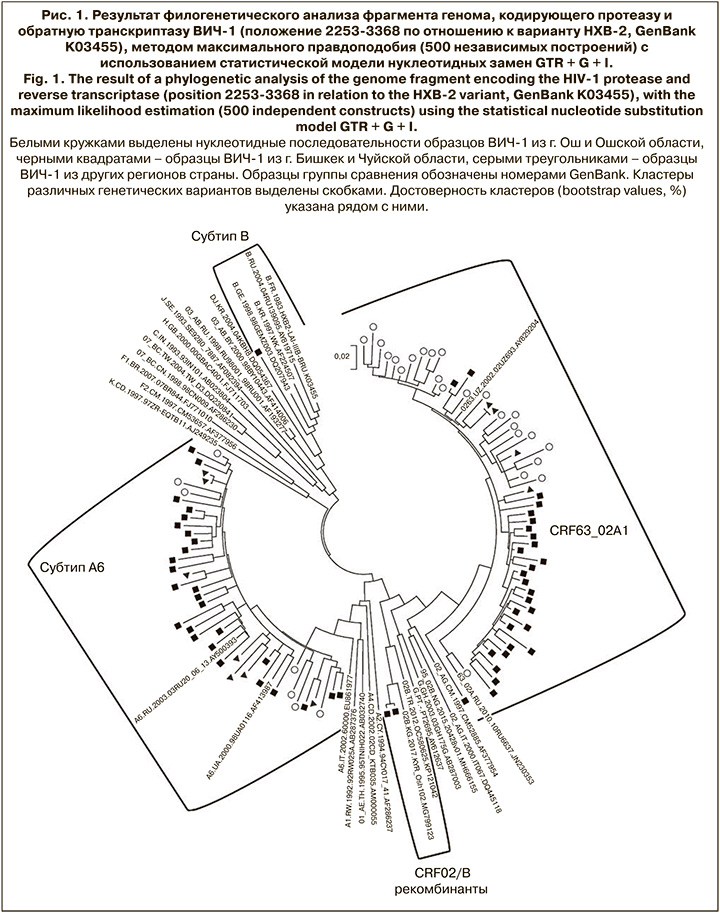
Отдельного внимания заслуживают 3 образца, давшие неожиданный результат генотипирования и потребовавшие дополнительного анализа [16]. Один образец, полученный от пациента из группы МСМ из Иссык-Кульской области, но длительное время проживающего на территории России, содержал вирус субтипа B, характерного для данной уязвимой группы и стран Западной Европы (GenBank номер AY835777). Еще 2 образца от супружеской пары из г. Бишкек содержали вирус, генетически близкий к рекомбинантным формам CRF94_cpx (GenBank номер MH141493) и CRF95_02B (GenBank номер MH666160).
Наиболее часто отмечалась резистентность высокого уровня к EFV и NVP (48 и 50% образцов соответственно), несколько реже – к FTC и 3TC (39% образцов) (рис. 2, а).
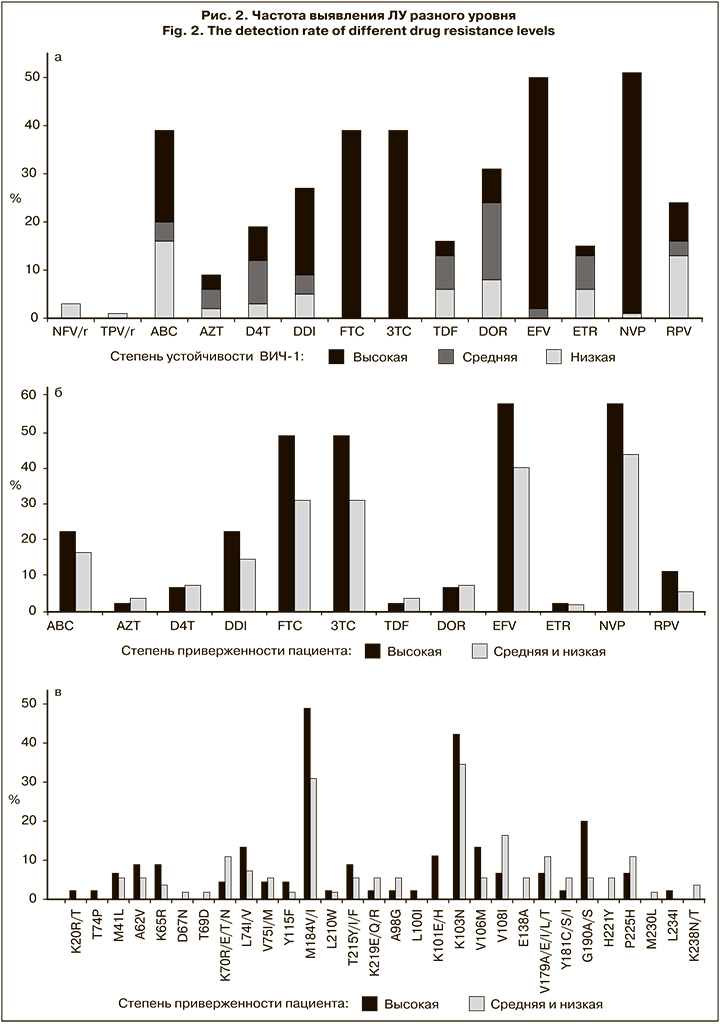
Для оценки частоты встречаемости устойчивости высокого уровня в образцах от пациентов с разной степенью приверженности лечению сравнивали образцы от пациентов с высокой приверженностью (n = 45) и остальных образцов (n = 55), включающих образцы от пациентов с умеренной/низкой и неизвестной приверженностью (приверженность для которых скорее могла быть оценена как низкая) (рис. 2, б и в). Установлено, что более высокий уровень устойчивости к EFV, NVP, FTC и 3TC в образцах от пациентов с высокой приверженностью связан с более высокой частотой таких мутаций, как M184V/I, K103N и G190S. Впрочем, обнаруженные различия были статистически недостоверны (p > 0,05)
Обсуждение
Полученные данные о распределении генетических вариантов в исследованной коллекции согласуются с ранее опубликованными данными о доминировании AG-рекомбинанта в Киргизской Республике и других странах Средней Азии [2, 7, 9]. В то же время важно учитывать накопленные на сегодняшний день знания о генотипах вируса для правильной интерпретации результатов генотипирования и оценки вклада отдельных вирусных вариантов, таких как CRF63_02A1 и A6, в общий эпидемиологический процесс.
Различное соотношение CRF63_02A1 и A6 в Чуйской и Ошской областях может быть связано с географическим положением этих областей. Так, Чуйская область граничит с Казахстаном, где ранее было отмечено доминирование A6 (IDU-A) [9], а Ошская область – с Таджикистаном и Узбекистаном, где, предположительно, образовался CRF63_02A1 [7].
Выявленный в 2 образцах вирус был генетически близок к описанным ранее генетическим формам CRF95_02B и CRF94_cpx. CRF95_02B, впервые выявленный в образцах от МСМ из Нигерии, собранных в 2013–2016 гг., по результатам вычисления ближайшего общего предка (анализ tMRCA) появился примерно 27–32 года назад в среде МСМ, совершающих поездки между Францией и странами Западной Африки [19]. Рекомбинант CRF94_cpx с высокой вероятностью появился приблизительно в 2012 г. и содержит в своем геноме участки, характерные для субтипа B, CRF02_AG и редкого суб-субтипа F2. CRF02 и F2 исторически циркулируют в Камеруне. Упомянутый субтип B характерен для стран Западной Европы, в том числе для Франции, где в среде МСМ и был выявлен и описан CRF94_cpx [20].
Заключение
Выявленная нами высокая частота ЛУ к препаратам, входящим в основные схемы АРТ, у пациентов с высокой приверженностью лечению говорит о необходимости дальнейшего мониторинга ЛУ в стране, в том числе среди пациентов без опыта терапии и только приступающих к ней.
Полученные в ходе работы нуклеотидные последовательности ВИЧ-1 были депонированы в GenBank под номерами MT452311–MT452410.
* * *
Исследование проведено в рамках исполнения Распоряжения Правительства РФ №2314-р от 14 ноября 2015 г. [НИР «Предотвращение распространения штаммов ВИЧ, резистентных к антиретровирусной терапии в странах-реципиентах помощи (РЕЗЕДА)»].



