Основной постулат в гипотезе появления и распространения ВИЧ-инфекции в мире указывает на то, что «колыбелью» этой пандемии является Центральная Африка [1–5]. Анализ первого в истории образца вируса, ZR59, полученного в 1959 г. в провинции Киншаса (столица Демократической Республики Конго), и сравнение его генома с другими образцами, собранными в этом регионе в более поздние сроки, позволили предположить, что в 20-е годы прошлого века произошло первое инфицирование человека вирусом группы SIV от шимпанзе [3].
Несмотря на то что к настоящему времени вирус распространился по всему земному шару, Африканский континент является лидером как по количеству инфицированных людей, так и по степени вирусного разнообразия.
По данным ЮНЭЙДС, на 2016 г. в Гвинейской Республике (ГР) было зарегистрировано 120 000 человек, живущих с ВИЧ, а от СПИДа умерли 5 800 человек. Наибольшее число ВИЧ-инфицированных отмечено в столице государства г. Конакри, а также в регионе Лесная Гвинея на юго-востоке страны, граничащем с Кот-д’Ивуаром, Либерией и Сье́рра-Лео́не. Так, в 2005 г. распространённость ВИЧ в Конакри составляла 5%, а в Лесной Гвинее – 7% [6]. Наиболее уязвимыми группами в ГР являются мужчины, имеющие секс с мужчинами (МСМ) (56,6% случаев), работники коммерческого секса (14,2%) и заключенные (8,5%) [7].
Доминирующим на сегодняшний день вариантом вируса в ГР является рекомбинантная форма ВИЧ-1 CRF02_AG, выявляемая разными авторами с различной частотой: 89% [8], 59,6% [9] и 73% [10]. В настоящее время в международной базе данных Национальной лаборатории Лос-Аламос (Los Alamos National Laboratory, США) депонированы всего 120 нуклеотидных последовательностей ВИЧ-1 из ГР, 80,8% которых относятся к CRF02_AG [11].
Кроме того, опубликованы данные о циркуляции в стране нерекомбинантных вариантов ВИЧ-1. В первую очередь это касается субтипов D и F. Доля каждого из них, по данным 2012 г., не превышала 20% в общей вирусной популяции [9]. Так, в исследовании, проведенном в 2014 г. с образцами от 136 ВИЧ-инфицированных, вирус субтипа D был выявлен лишь у 2 пациентов [10]. Также с небольшой частотой в Гвинее выявляют вирусы субтипов A: по данным Национальной лаборатории Лос-Аламос, примерно в 3% случаев [5]. Стоит отметить сходство выявляемого на территории ГР варианта ВИЧ-1 субтипа А1 и преобладающего на территории России и стран СНГ варианта IDU (FSU)-A. По данным молекулярно-филогенетического анализа, вариант А1, циркулирующий в Гвинее, с высокой вероятностью может быть предком варианта ВИЧ-1, доминирующего на территории СНГ [12].
Наконец в ГР в разное время в единичных случаях были выявлены такие редкие рекомбинантные комплексные формы, как CRF06_cpx [10] и CRF09_cpx [8].
Что касается циркуляции ВИЧ-2, то в самой ГР частота встречаемости этого вируса невелика – не более 5% [9]. Тем не менее он широко представлен в соседних с ГР государствах: Сенегале, Гамбии, Кот-д’Ивуаре и Гвинее-Бисау [13], что создает предпосылки для роста числа случаев инфекции ВИЧ-2 в ГР.
Охват ВИЧ-инфицированных лиц терапией в стране год от года увеличивается. Если в 2010 г. антиретровирусную терапию (АРТ) получали не более 5% пациентов, то в период с 2010 по 2014 г. доступ к препаратам имели 27%, а к 2016 г. – уже 35% [7].
В связи с этим особого внимания заслуживает проблема распространения в ГР передаваемой и приобретенной лекарственной устойчивости (ЛУ) ВИЧ-1. Исследование, проведенное в Конакри в 2011 г., не только продемонстрировало доминирование варианта CRF02_AG (89% случаев), но и показало, что частота встречаемости мутаций, ассоциированных с ЛУ, у пациентов без опыта АРТ составляет 8,6%, что является высоким показателем ЛУ по сравнению с другими странами Западной Африки [8]. При этом чаще всего встречались мутации ЛУ к ННИОТ, такие как K101E, K103N и Y181C.
Значительное влияние на оказание медицинской помощи и профилактику ВИЧ-инфекции на территории ГР оказала вспышка лихорадки Эбола (EVD). Эпидемия, начавшаяся в феврале 2014 г. и официально побежденная в конце 2015 г., унесла жизни более 2500 человек [14] и сильно нарушила отлаженную работу органов здравоохранения страны не только из-за смертельных случаев среди медицинского персонала, но и из-за отвлечения основных финансовых и человеческих ресурсов [15]. В результате в период с июня по декабрь 2014 г. в Национальном госпитале Донка (одном из ведущих медицинских центров по лечению ВИЧ-инфекции и EVD) число пациентов, получающих АРТ в медицинских учреждениях, сократилось на 42% [16].
Целью настоящего исследования был молекулярно-биологический анализ вариантов ВИЧ, циркулировавших на территории ГР в 2015–2017 гг.
Материалы и методы
Была собрана коллекция образцов плазмы крови от граждан, проживающих в ГР. Образцы тестировали с помощью набора реагентов «АмплиСенс HCV/HBV/HIV-1/2-FL» производства ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора (Москва, Россия; далее – ЦНИИЭ) для выявления инфекции вирусами гепатитов С и В, ВИЧ-1 и ВИЧ-2.
Выборочно образцы, давшие положительный результат на РНК ВИЧ-1, исследовали с помощью набора «АмплиСенс HIV-Resist-Seq» (ЦНИИЭ). В результате были получены нуклеотидные последовательности региона pol (позиции 2253–3262 референсного штамма HXB-2), кодирующего протеазу и часть обратной транскриптазы ВИЧ-1.
Секвенирование очищенных фрагментов проводили с помощью генетических анализаторов Applied Biosystems (LifeTechnologies, США) в соответствии с инструкциями производителя. Обработку данных секвенирования и получение консенсусной нуклеотидной последовательности осуществляли с помощью программного обеспечения «ДЕОНА», версия 1.2.3 (ЦНИИЭ).
Предварительное определение генотипа проводили с помощью онлайн приложений REGA HIV-1 Subtyping Tool v3.0 [17] и COMET HIV-1 v2.2 [18]. Для выравнивания нуклеотидных последовательностей и филогенетического анализа использовали программу MEGA 6.0.
Для анализа основных мутаций резистентности и ЛУ ВИЧ-1 использовали базу данных Стэнфордского университета (Stanford University, США) HIVdb v8.4. [19].
Результаты
В общей сложности были проанализированы образцы плазмы крови 5566 человек, обращавшихся за медицинской помощью с февраля 2015 г. по октябрь 2017 г. Средний возраст пациентов, указавших дату рождения (4698 человек, 84,41% исследуемой выборки), составил 33 года: 34 года для мужчин (2258 человек) и 31 год для женщин (1778 человек). Среди участников исследования было 56% мужчин и 44% женщин.
В ходе тестирования клинических образцов на РНК ВИЧ-2 не было получено ни одного положительного результата. В то же время в 200 (3,59%) образцах была обнаружена РНК ВИЧ-1. На момент забора крови у всех пациентов не было опыта приема антиретровирусных препаратов. Средний возраст пациентов с положительным результатом составил 36 лет, при этом для женщин он составлял 32 года, для мужчин – 39 лет. В исследуемой выборке, в которой был известен пол пациента, частота встречаемости ВИЧ-1 среди мужского населения составила 3,34% (83 человек из 2486), среди женского – 4,26% (84 из 1970).
Генетическая характеристика циркулирующих вариантов ВИЧ-1
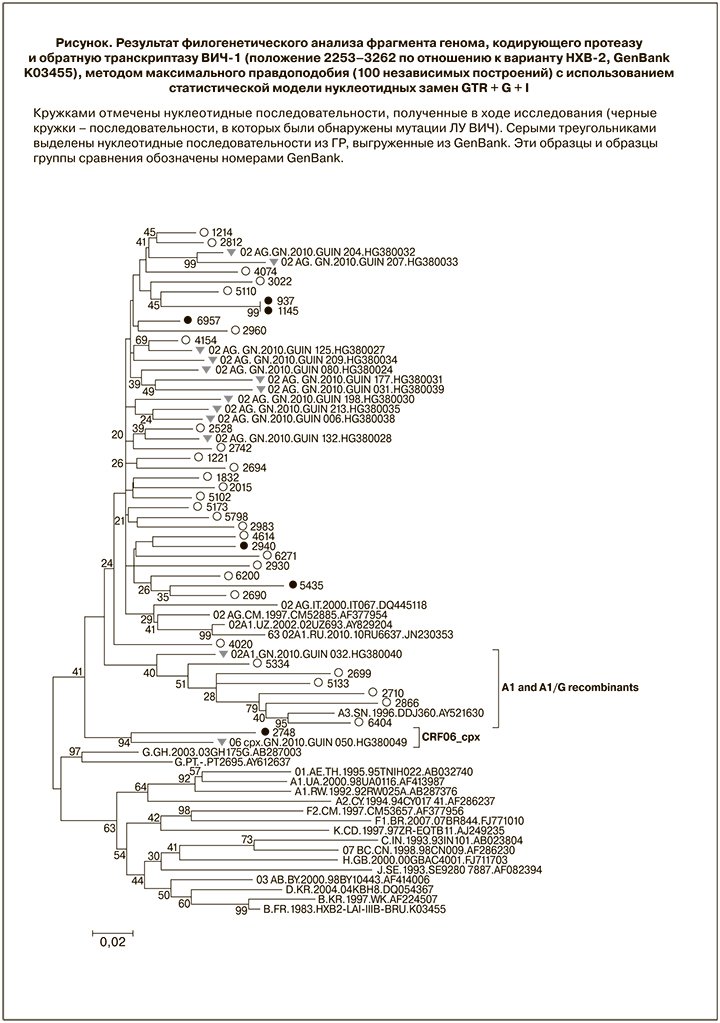
В общей сложности были получены последовательности (сиквенсы) для 35 образцов, 7 из которых были собраны в 2015 г., 20 – в 2016 г. и 8 – в 2017 г. (табл. 1). Был известен пол 24 пациентов (12 мужчин и 12 женщин). Средний возраст пациентов составил 33 года (36 лет для мужчин и 30 лет для женщин). Предварительное генотипирование позволило выявить 27 (77,14%) образцов, относящихся к CRF02_AG. 3 образца достоверно относились к субтипу A1. Для других 3 образцов не было получено достоверных результатов генотипирования, они предположительно были отнесены к рекомбинантам субтипов A1 и G. По одному образцу было отнесено к субтипам G и CRF06_cpx.
Филогенетический анализ подтвердил результаты предварительного генотипирования (см. рисунок). Все последовательности из ГР, полученные в ходе данной работы, образовывали общую ветвь с сиквенсами из этой страны, депонированными ранее в GenBank. В то же время, образцы с недостоверными результатами предварительного генотипирования образовывали субкластер с полученными сиквенсами субтипа A1 и с рекомбинантом вирусов CRF02_AG и субтипа A1 (02A1-рекомбинантом) из ГР. Это может свидетельствовать о том, что описанные нами образцы с недостоверным результатом генотипирования могут относиться к новым, редким или уникальным рекомбинантным формам, образованным субтипом A1 и CRF02_AG. Также предварительно генотипированнный образец CRF06_cpx достоверно кластеризовался с референтной последовательностью этой генетической формы.
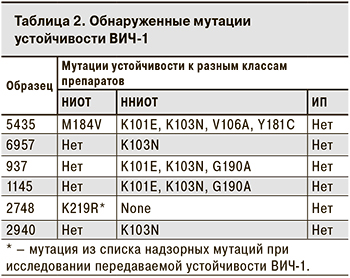 При анализе последовательностей на наличие мутаций устойчивости из списка основных (major) в соответствии с рекомендациями от 4 февраля 2019 г. [20], было выявлено, что 6 (17,14%) образцов содержали как минимум 1 мутацию (табл. 2).
При анализе последовательностей на наличие мутаций устойчивости из списка основных (major) в соответствии с рекомендациями от 4 февраля 2019 г. [20], было выявлено, что 6 (17,14%) образцов содержали как минимум 1 мутацию (табл. 2).
Наиболее часто выявляли неполиморфные мутации области обратной транскриптазы (K101E и K103N), ассоциированные с устойчивостью к NVP, EFV и RPV. Устойчивости к ИП выявлено не было.
При дальнейшем изучении последовательностей на наличие других мутаций устойчивости или полиморфизмов [18] было выявлено, что образцы 937 и 1145 содержали E138K – неполиморфную мутацию, часто выявляемую у лиц, принимающих RPV. E138K снижает чувствительность к RPV в 2–3 раза, однако комбинация E138K и K101E с высокой вероятностью приводит к вирусологической неудаче. Наконец, 1 образец (2940) содержал замену E138A, связанную с низким уровнем устойчивости к RPV.
Необходимо также отметить, что образцы 937 и 1145 имели высокое генетическое сходство (99,47%), что позволяет предположить их эпидемиологическую связь связь друг с другом.
Нами был проведен скрининговый анализ 5566 образцов плазмы крови граждан, проживающих в ГР. Инфекция ВИЧ-1 была диагностирована у 3,59%, что может быть следствием сбора образцов в крупных населенных пунктах, где пораженность населения достигает 5–7%. Были проанализированы области гена pol ВИЧ-1, кодирующие протеазу и обратную транскриптазу в 35 образцах. Полученные данные о принадлежности 30 (85,71%) образцов к AG-рекомбинантам подтверждают ранее опубликованные материалы о доминировании такой рекомбинантной формы в ГР. В то же время нам удалось выявить образцы подтипов A1, G и CRF06_cpx.
ЛУ, ассоциированная с резистентностью к НИОТ и ННИОТ (чаще всего – к NVP и EFV), была выявлена у 17,14% пациентов, для которых были получены нуклеотидные последовательности гена pol. Такой высокий уровень распространенности ЛУ в среде пациентов без опыта АРТ может быть связан с нарушением приверженности терапии в ГР в последние годы на фоне страха перед лихорадкой Эбола и нежеланием населения посещать лечебные учреждения.
Заключение
В результате иссследования были получены данные о распространении в ГР вариантов вируса, устойчивых к наиболее распространенным лекарственным препаратам классов НИОТ и ННИОТ. Для детальной характеристики эпидемической ситуации по ВИЧ-инфекции требуются более масштабные исследования с увеличением количества образцов, что исключает возможность смещения исследуемой выборки.
Полученные в ходе работы нуклеотидные последовательности генома ВИЧ-1 депонированы в международную базу данных GenBank под номерами MK067006–MK067040.
* * *
Публикация подготовлена в рамках реализации НИР по распоряжению Правительства Российской Федерации от 25 июля 2015 г. № 1448-р.



