На фоне эпизодических выделений единичных токсигенных штаммов Vibrio cholerae биовара Эль-Тор из объектов окружающей среды (ООС) и от человека (заносы) ежегодно обнаруживают нетоксигенные культуры этих микроорганизмов, в основном в водных ООС [1–3]. Наряду с этим встречаются изоляты из клинического материала [4–6], в среднем, по данным Референс-центра по мониторингу холеры (ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора), на территории Российской Федерации за период 2000–2016гг. – по 53 штамма в год. Изучение нетоксигенных штаммов холерных вибрионов различного происхождения на молекулярно-биологическом уровне обосновано установленной их ролью в этиологии спорадических случаев и вспышек диарейных заболеваний. Примером могут служить факты регистрации единичных случаев острых кишечных инфекций в Ростовской области, Республике Калмыкия, а также осложнение эпидемической ситуации по холере в Каменском районе Ростовской области в 2005 г., вызванные нетоксигенными (ctxA-tcpA+) штаммами V. cholerae О1 и др. [7].
Значение штаммов холерных вибрионов с генетической характеристикой (ctxA-tcpA+)1 трактуется неоднозначно [8].
Следует учитывать, что геном холерного вибриона высокопластичен, что обусловливает генетическую неоднородность популяций, обнаруживаемых на разных территориях.
С одной стороны, их позиционируют как «потенциально эпидемически опасные»2,3 [9], с другой – существует предположение, что нетоксигенные штаммы, изолированные из водной среды на неэндемичной территории России, имеющие различные связанные с патогенностью гены, следует расценивать как штаммы с более низким потенциалом вирулентности, чем эпидемические, не имеющие особенностей, связанных с эпидемическим потенциалом [10, 11].
Способность к обмену генетической информацией позволят считать природные популяции этих микроорганизмов резервуарами генов, которые в условиях умеренного климата представляют собой скорее динамичные, чем постоянные сообщества с горизонтальной передачей определенных аллелей генов и формированием новых геновариантов [12–15]. Следовательно, при выделении нетоксигенных штаммов V. cholerae возникает необходимость разработки подхода к их систематизации, связанного с установлением их генотипов, то есть выявления сходств/различий со штаммами как вновь выделенными, так и обнаруженными ранее, а также установление их происхождения (занос/переживание).
В связи с этим целью настоящего исследования стало ПЦР-генотипирование (с высокой дискриминирующей силой) нетоксигенных изолятов холерных вибрионов, выделенных из ООС, с использованием статистического рассчитанного оптимального количества определяемых генетических детерминант факторов патогенности.
Материалы и методы
В работе использовали репрезентативную выборку из 408 штаммов, выделенных из ООС на территории всех федеральных округов России с 1989 по 2016 г. Исследуемые культуры были идентифицированы в Референс-центре по мониторингу холеры. Материалом для ПЦР служили супернатанты прогретых при 100 оС взвесей суточных агаровых культур в дистиллированной воде. Амплификацию искомых фрагментов генов факторов патогенности с помощью специфических праймеров осуществляли на программируемом термостате «Терцик» (ЗАО «НПФ ДНК-Технология», Москва). Синтез праймеров выполнен ООО «СибЭнзим» (Новосибирск) и НПФ «Литех» (Москва). В качестве контролей использовали штаммы V. cholerae O1 (М-878), V. cholerae O1 (14863), V. cholerae O1 (18846). Реакцию учитывали по визуализации результатов электрофореза в ультрафиолетовом свете с использованием трансиллюминатора, то есть по наличию/отсутствию амплификатов соответствующей длины, которые сравнивали с таковыми у контрольных штаммов.
Генотипирование штаммов холерных вибрионов проводили по детекции 39 генетических детерминант факторов патогенности [16].
Дискриминирующую силу, то есть способность отличать различные штаммы друг от друга, вычисляли по формуле Симпсона [17].
Результаты
Для системы генотипирования, основанной на постановке расширенной ПЦР с целью выявлении наличия/отсутствия тех или иных генов, дискриминирующая сила будет напрямую зависеть от числа изучаемых генов. Однако при увеличении числа изучаемых признаков увеличивается и время проведения исследования, что в свою очередь делает актуальными работы по определению оптимального числа и набора генов, использование которого дает возможность проведения генотипирования с высокой дискриминирующей силой.
Подбор оптимального числа генов проводили, используя статистическую обработку данных с помощью разработанной авторами таблицы, предназначенной только для реализации данного этапа работы, то есть для установления минимального числа определяемых генов (с учетом вариабельности генетических детерминант) с применением введенного нами «коэффициента совместимости» (КС). КС – повторяемость сочетанных генов (выражается количественно – от 0 до 20). Чем больше значение коэффициента, тем в большей степени отражена целесообразность сочетания вариабельных генетических детерминант. При генотипировании по 39 генетическим детерминантам факторов патогенности холерных вибрионов результаты базировались на учете детекции генов, имеющих наибольший КС в разных парных комбинациях. Комбинации с показателем КС от 0 до 1 (ctxAB, cep, orfU, ace, zot, rstR, rstC; hapA; toxR; slt1; tdh; trh; wbe; wbf; attRS; hcp; cef; tolQRA) для системы генотипирования не использовали по вышеуказанной причине. Сначала нами были проанализированы информативные комбинации, имеющие КС более 10, а именно: 1 ген из острова VPI – tcpA; гены острова VPI2 – int, nanH, vce; ген кластера RTX – acd-rtxA; гены T6SS – vspD, pbd-vgrG3, acd-vgrG1, mshA, а также один из генов T3SS – vcsN2 и stn/sto. В результате было отобрано 11 генетических детерминант. В процессе дальнейшей работы был проведен анализ, который позволил нам отобрать еще 3 гена с КС от 7 до 2: ген rstA (RS1, RS2 элементов); rtxC (один из генов кластера RTX), а также ген T3SS – vasK.
Анализ сочетания парных генетических детерминант из 39 генов, праймерами к которым мы располагали на момент изучения штаммов, позволил нам составить комбинацию минимального количества (14) генов для последующего определения их дискриминирующей силы (разрешающей способности) при генотипировании (табл.1).
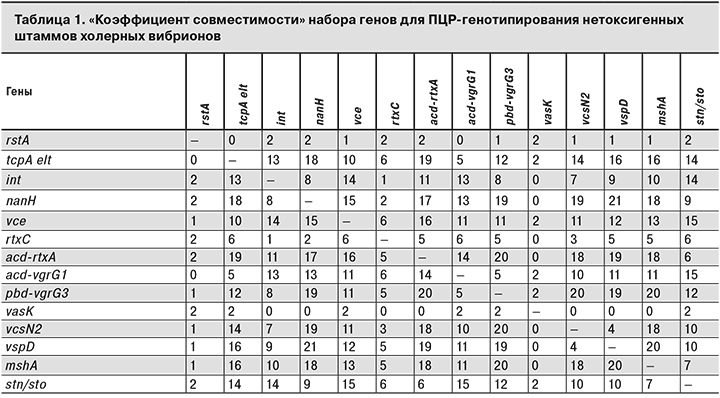
Дискриминирующую силу рассчитывали следующим образом: при генотипировании 408 штаммов V. cholerae по 39 генам удалось выявить гены, а также их парное сочетание и установить принадлежность к 90 уникальным генотипам с дискриминирующей силой 0,924. В то же время использование 14 отобранных нами генов на этой же коллекции штаммов позволило выявить 81 генотип с дискриминирующей силой 0,921.
Таким образом, уменьшение исследуемых генов более чем в 2 раза практически не повлияло на разрешающую способность системы генотипирования. Для отработки подхода к систематизации нетоксигенных штаммов холерных вибрионов установленный 81 генотип (по 14 оптимально достаточных генов для выявления различий между штаммами) был сгруппирован в 10 кластеров (табл. 2).
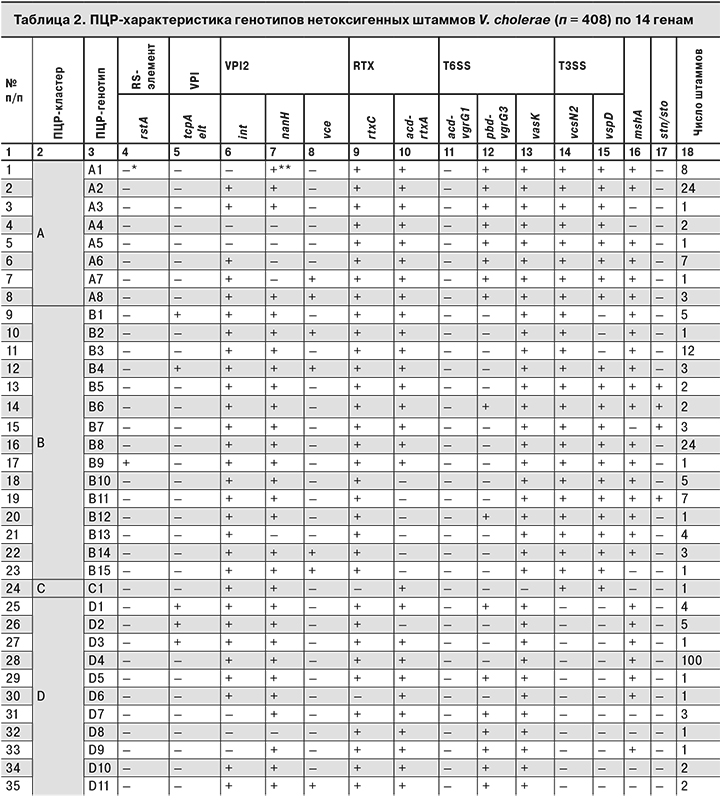
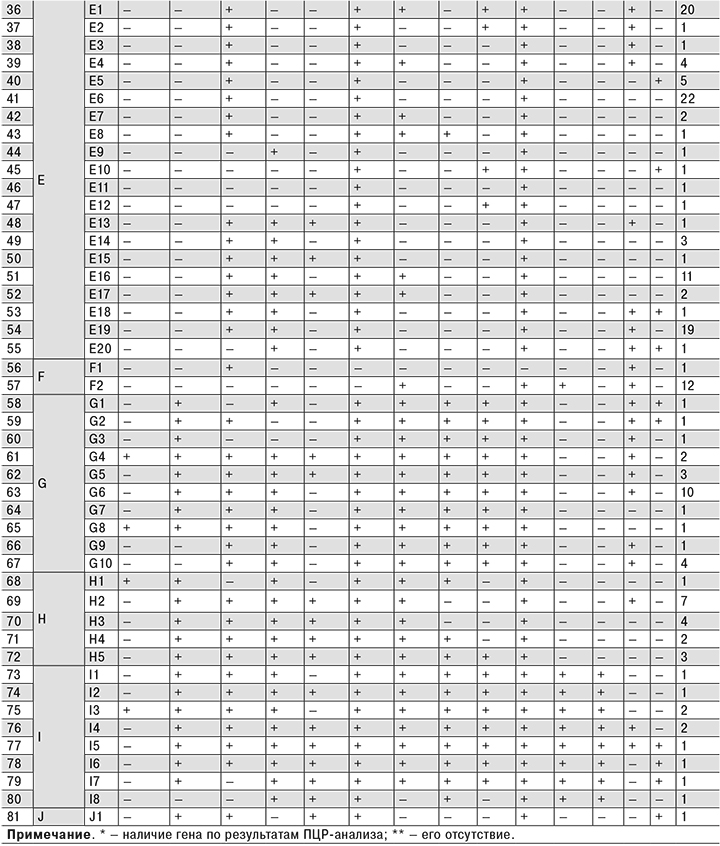
Результаты ПЦР-генотипирования по 14 генам нетоксигенных штаммов холерных вибрионов разного происхождения (как прошедших идентификацию в Референс-центре по мониторингу холеры, так и, возможно, прошедших ПЦР-генотипирование в научно-исследовательских противочумных учреждениях и присланных в ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора в виде паспортных данных на штамм) учитывают с помощью авторской пополняемой базы данных ГИС «Холера 1989–2014»4, интегрированной в геоинформационный портал института (http://gis.antiplague.ru/s_cholera-genes.php), где устанавливается принадлежность того или иного штамма к определенному генотипу на момент исследования. Портал доступен всем сотрудникам Роспотребнадзора по логину «rospotrebnadzor» и паролю по запросу (рисунок см. на вклейке).
Прикладной характер подхода к систематизации нетоксигенных штаммов демонстрируют следующие результаты. На территории Краснодарского края из р. Агура в 1993, 1999 и 2007 гг. были выделены нетоксигенные штаммы V. cholerae O1, которые по результатам генотипирования оказались принадлежащими к одному генотипу – G10, что свидетельствовало об их персистентном потенциале. В 2015 г. на территории Краснодарского края из р. Агура было изолировано 118 нетоксигенных штаммов V. cholerae О1, 89 из которых были идентифицированы в ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора.
В результате генотипирования по 14 генам у всех штаммов был установлен новый (ранее не встречавшийся) генотип – D4, что рассматривалось как вероятный занос. С 2001 по 2016 г. на территории Российской Федерации было выделено 65 нетоксигенных штаммов холерных вибрионов серогруппы О1 с генетической характеристикой ctxA-tcpA+. По результатам ПЦР-исследований была установлена принадлежность этих штаммов к 26 генотипам (см. табл. 2). Нетоксигенные штаммы холерных вибрионов ctxA-tcpA+ входили как в отдельные кластеры (H, J), так и в общие с культурами ctxA-tcpA- (B, D, G, I), что, по нашему мнению, свидетельствует об отсутствии особенностей, связанных с эпидемическим потенциалом штаммов, но не исключает их повышенной роли как этиологического фактора острых кишечных инфекций за счет большей вероятности реализации способности к адгезии и колонизации кишечника5 [9–11, 18, 19].
Результаты ПЦР-генотипирования нетоксигенных штаммов холерных вибрионов по 14 генам могут быть сопоставлены с результатами других молекулярно-биологических методов (VNTR-типирование, INDEL-типирование и др.) [20] с перспективой совершенствования предложенного метода при участии других противочумных учреждений.
Заключение
Разработанный нами подход к систематизации нетоксигенных штаммов холерных вибрионов дает вспомогательную информацию при проведении эпидрасследований по фактам обнаружения таких штаммов в ООС на территориях федеральных округов и субъектов Российской Федерации в рамках эпидемиологического надзора за холерой (при меньшей, по сравнению с секвенированием, затрате сил и средств).



