Ежегодный мониторинг объектов окружающей среды (ООС) на наличие холерных вибрионов остается одним из ключевых факторов, способствующих оптимизации системы эпидемиологического надзора на контролируемой территории, а лабораторная диагностика холеры – основным прикладным инструментом обнаружения и характеристики выделенных культур. Проведенный ретроспективный анализ результатов мониторинговых исследований на вибриофлору в пространственном формате показал, что за исследуемый период из ООС были изолированы штаммы V. cholerae El Tor на территориях всех федеральных округов, но не всех субъектов, входящих в них. При количественном анализе интенсивности выделения штаммов холерных вибрионов О1 Эль Тор по субъектам России установлено, что большее число изолятов обнаруживали на территории Республики Калмыкия [1, 2]. Данные, полученные за последние 5 лет1-3, показали, что токсигенные штаммы, содержащие полный набор ключевых генов вирулентности (ctxA, tcpA), а также генов островов пандемичности VSP-I и VSP-II, на данной территории выявлены не были, но ежегодно, начиная с 1974 г., из воды открытых водоемов выделяли десятки нетоксигенных культур V. cholerae О1 El Tor, среди которых встречались штаммы ctxA-tcpA+, которые, как и ранее выделенные на других территориях России, не содержали островов пандемичности и являлись эпидемически безопасным. Вместе с тем ген tcpA – генетический маркер острова патогенности VPI-2, продукты которого участвуют в колонизации тонкого кишечника. Кроме того, нельзя игнорировать выявленный высокий уровень продукции нетоксигенными штаммами термолабильного гемолизина, являющегося дополнительным фактором патогенности, что не исключает способности данных штаммов вызывать развитие патологического процесса у инфицированных людей (гастроэнтериты) [3, 4].
Интенсивность ежегодного обнаружения в ООС штаммов V. cholerae О1 El Tor и выявление особенностей их биологических свойств свидетельствовали о нестабильности эпидемической обстановки по холере в Республике Калмыкия и обусловили актуальность более углубленного дальнейшего изучения динамики выделения, а также фено- и генотипических характеристик штаммов.
Целью настоящего исследования явился анализ результатов мониторинга холерных вибрионов на территории Республики Калмыкия с 2013 по 2017 г.
Материалы и методы
В работе использовали 105 нетоксигенных штаммов холерных вибрионов Эль Тор, выделенных из ООС на территории Республики Калмыкия и отобранных с помощью ГИС «Холера 1989–2014»4, которые были идентифицированы в Референс-центре по мониторингу холеры (ФКУЗ «Ростовский-на-Дону противочумный институт» Роспотребнадзора) в соответствии с действующими нормативными документами5. ПЦР-генотипирование нетоксигенных штаммов V. cholerae проводили при помощи ранее разработанного способа6. Статистическую обработку полученных результатов проводили с помощью компьютерной программы «STATISTIKA» (StatSoft Russia).
Результаты
Установлено, что наибольшее количество штаммов холерных вибрионов О1 было выделено из проб воды следующих водоемов: пруды Заячий (55 штаммов или 52,4% от общего количества культур), Колонский (28 штаммов или 26,7%), р. Элистинка (14 штаммов или 13,3%).
По данным ФКУЗ «Элистинская ПЧС» Роспотребнадзора, обнаружение V. cholerae О1 El Tor связано с особенностями природно-климатических условий: с высокими показателями температуры воздуха и воды в летние месяцы в период с 2013 по 2017 г., что коррелирует с их наибольшим количественным выделением именно в эти годы; с наличием неглубоких пресноводных водоемов, расположенных в черте г. Элисты7, и, по-видимому, с уровнем подготовки специалистов, то есть с качеством проводимых исследований. Однако по данным паспортов на штаммы, пришедших на идентификацию, имело место дублирование отборов проб из одной и той же точки двумя учреждениями – ФБУЗ «Центр гигиены и эпидемиологии в Республике Калмыкия» и «ФКУЗ Элистинская ПЧС», что отражалось на объективности количественных показателей.
По нашим данным, все выделенные культуры холерных вибрионов были типичны по родовым и видовым свойствам, а именно: по культурально-морфологическим, биохимическим и серологическим свойствам, а также образовывали ацетилметилкарбинол из глюкозы в реакции Фогес–Проскауэра, давали рост на среде с полимиксином В и относились к V. cholerae O1 El Tor.
Результаты серологических исследований показали, что наиболее высокий процент выделенных культур холерных вибрионов O1 Эль Тор относился к серовару Огава – 93,3%, а к серовару Инаба – 6,7%.
При изучении чувствительности к холерным диагностическим фагам (эльтор и классический) выявлена изменчивость нетоксигенных изолятов V. choleraе О1 El Tor. Так, нами было установлено, что количество чувствительных нетоксигенных штаммов холерных вибрионов O1 к вышеуказанным фагам составило 14,3% от общего числа обнаруженных штаммов. Что касается изолятов, чувствительных только к фагу эльтор, то их количество составило 10,5 %. Обнаружены изоляты холерных вибрионов, чувствительные к классическому фагу (2,9 %), но резистентные к диагностическому бактериофагу эльтор. В 2013 г. был выделен нетоксигенный штамм V. cholerae О1 El Tor (0,9%), который лизировался как классическим, так и бактериофагами эльтор до рабочего титра. Мы согласны с объяснениями изменчивости по фагочувствительности, приведенными в литературе [5, 6]. Считаем, что начиная с 90-х годов стали появляться отдельные штаммы холерных вибрионов Эль Тор с измененной чувствительностью к коммерческим диагностическим холерным бактериофагам – классическому и эльтор. Возможными причинами, приведшими к изменениям фагочувствительности холерных вибрионов к диагностическим бактериофагам, являются генетические изменения штаммов V. cholerae О1 El Tor, что в свою очередь приводит к нарушению гомологии зон рецепции фага и клетки, а также к нарушению нормального функционирования систем рестрикции-модификации различной при специфичном взаимодействии фага и бактериальной клетки.
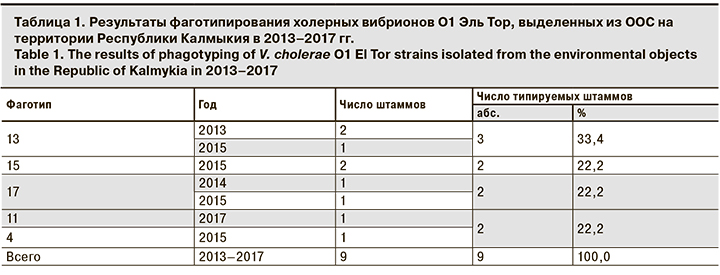
Далее в ходе проведенного анализа удалось установить принадлежность к определенному фаготипу 9 (8,6%) штаммов V. cholerae О1 El Tor, причем большинство принадлежало к 13-му фаготипу. Наряду с этим были выявлены штаммы V. cholerae O1 El Tor с фаготипами, которые встречались только на территории Республики Калмыкия, например, изоляты с фаготипом 17. В результате анализа штаммов V. cholerae О1 с различными фаготипами, выделенных из ООС на территории Республики Калмыкия в разные годы, было установлено, что культуры, принадлежащие к фаготипам 4, 11, 15, обнаруживали однократно. Вместе с тем штаммы холерных вибрионов О1, относящиеся к фаготипам 13 и 17, выделялись не более 2 лет (табл. 1).
Дальнейшие исследования были посвящены углубленному изучению генетических особенностей вышеуказанных штаммов8. По результатам ПЦР-генотипирования (по расширенному спектру, включающему 14 генов-мишеней) [7] было установлено, что наибольшее число нетоксигенных культур вошло в кластер B (43 штамма или 41,0%), состоящий из 12 генотипов, которые были представлены разнообразным сочетанием генов в сравнении с другими кластерами и отличались по наличию/отсутствию от 1 до 9 генов (табл. 2).
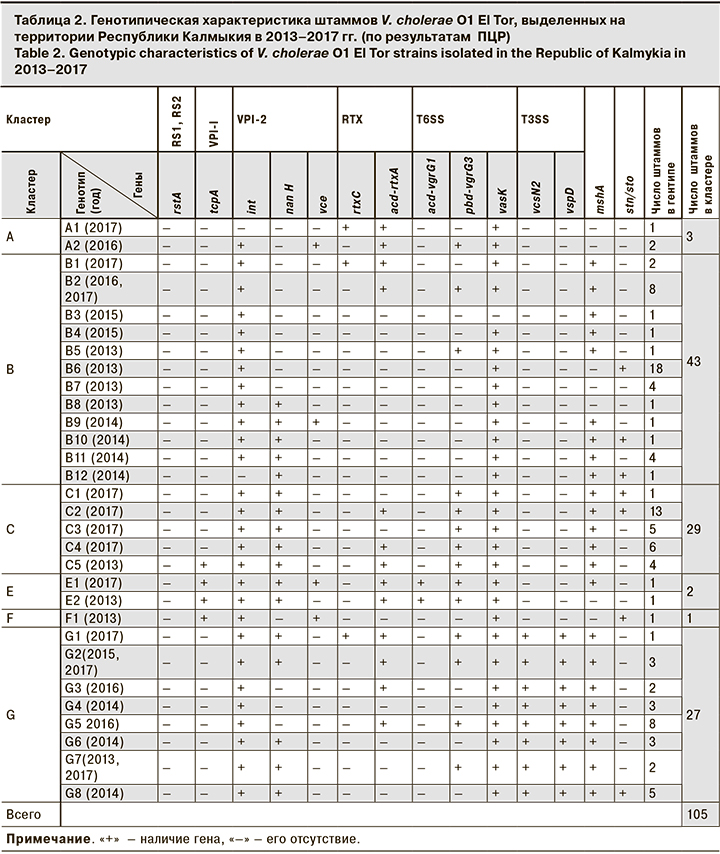
Такой же кластер был обнаружен в различные годы на территориях 8 субъектов Российской Федерации: в республиках Коми и Бурятия, Краснодарском, Забайкальский, Приморский краях, Свердловской и Московской областях. Определенный интерес представлял кластер С, состоящий из 29 (27,6%) штаммов, объединённых в 5 генотипов, которые различались по наличию/отсутствию от 1 до 3 генов. Штаммы холерных вибрионов, относящиеся к этому кластеру, были обнаружены только на территориях Республики Калмыкия и в Ростовской области. Относительно 27 (25,7%) штаммов V. cholerae O1 (25,7%), вошедших в кластер G, состоящий из 8 генотипов, было установлено, что в большинстве случаев культуры, содержащие гены кластера T3SS, не имели детерминант acd-vgrG1, тогда как культуры, не имеющие T3SS, содержали acd-vgrG1.
Обсуждение
Полученные нами результаты подтверждают литературные данные [8] о том, что холерным вибрионам достаточно экспрессии одной из двух контакт-зависимых систем секреции, так как поддержание активности обеих одновременно, возможно, для них энергетически невыгодно. Данный кластер был распространен практически повсеместно, он встречался на 16 административных территориях России: в республиках Бурятия, Калмыкия, Крым, Татарстан; в Алтайском, Забайкальском, Краснодарском, Приморском, Ставропольском краях; в Иркутской, Калининградской, Псковской, Ростовской, Рязанской, Свердловской, Челябинской областях9. Стоит отметить, что штаммы V. choleraе O1 с генетической характеристикой ctxA-tcpA+ составили уникальный кластер Е (2 генотипа): генотип Е1 был представлен штаммом, имеющим гены островов VPI-1, VPI-2 кластера T6SS и mshA, в то же время генотип Е2 имел неполный набор генов острова VPI-2 с отсутствием гена mshA. Учитывая, что ген tcpA считается главным фактором колонизации кишечника, a mshA связывают в основном с персистенцией в водоемах за счет формирования биопленок [8–10], штаммы с такой генетической характеристикой требуют дальнейшего изучения.
В ходе исследований нами был выявлен штамм холерного вибриона О1, входящий в кластер F (генотип F1). Особенностью генотипа этого кластера явилось наличие генов токсин-корегулируемых пилей (tcpA) и термостабильного токсина, мощного фактора патогенности (stn/sto), довольно часто встречающегося у азиатских штаммов разных серогрупп.
В последние годы отмечено появление нового кластера А, состоящего из 2 генотипов, ранее не встречавшихся на территории Республики Калмыкия, но зарегистрированных в Иркутской, Ростовской и Челябинской областях9.
Заключение
Подводя итог проведенной работы, следует отметить интенсивность выделения штаммов V. cholerae О1 El Tor на территории Республики Калмыкия за изучаемый период, несмотря на имевшее место дублирование исследований. Сравнительный фенотипический анализ результативности мониторинговых исследований на холеру показал изменчивость штаммов холерных вибрионов О1 Эль Тор, выделенных из ООС по признаку фаголизабельности, в частности, появление резистентности по отношению к холерному диагностическому фагу эльтор и чувствительности к классическому бактериофагу. Установлено, что в изучаемый период штаммы V. cholerae О1 El Tor одного и того же фаготипа выделяли как в разные годы, так и в течение одного года.
ПЦР-генотипирование выявило генетическое разнообразие нетоксигенных штаммов холерных вибрионов, изолированных на территории Республики Калмыкия в 2013–2017 гг., за счет того, что гены факторов патогенности/персистенции у изученных штаммов выявлены в различных сочетаниях. Наличие такого набора генетических детерминант у штаммов О1 указывает на то, что водные ООС могут рассматриваться как резервуар генов патогенности/персистенции.
Полученные данные свидетельствуют о том, что нетоксигенные штаммы холерных вибрионов О1 могут переживать в пресноводных водоемах от 1 года до нескольких лети и что водные экосистемы Республики Калмыкия имеют наиболее благоприятные условия для переживания в них на протяжении ряда лет нетоксигенных штаммов V. cholerae О1 El Tor, не исключая при этом новых заносов.



