Инфекции, связанных с оказанием медицинской помощи, представляют серьезную проблему для лечения и реабилитации пациентов кардиохирургического профиля. Особого внимания требуют внутрибольничные штаммы микроорганизмов рода Acinetobacter и Klebsiella, резистентные к антибиотикам. Проведен ретроспективный анализ состояния кожи и окружающей среды пациентов после ортотопической трансплантации сердца в раннем послеоперационном периоде на предмет контаминации данными микроорганизмами. В исследовании использованы данные 194 пациентов, прооперированных в период с 01.01.2013 по 31.12.2016. Установлено, что контаминация кожи и окружающей среды пациентов после операции более чем в 3 раза увеличивает риск развития бактериальной инфекции крови (БИК), ассоциированной с данными микроорганизмами. Эпидемиологический мониторинг состояния кожи и внешней среды пациентов в раннем послеоперационном периоде может выступать эффективным прогностическим инструментом в вопросах профилактики и снижения риска развития БИК.
Несмотря на последние достижения высокотехнологичной хирургии, исход проведенных операций часто определяется инфекцией, связанной с оказанием медицинской помощи (ИСМП), которая является важнейшей причиной заболеваемости и смертности пациентов, перенесших трансплантацию органов [1–7].
В последние годы растущей проблемой как в мире, так и в нашей стране стали ИСМП, вызванные внутрибольничными штаммами Acinetobacter baumannii и Klebsiella pneumoniaе с множественной лекарственной устойчивостью [8–14]. Кроме того, эти патогены могут длительное время сохраняться в окружающей среде стационаров и формировать биопленки на различных поверхностях [15–20]. В некоторых странах уже проводится тщательный мониторинг распространения этих видов грамотрицательных бактерий на предметах обихода в стационарах, а также в качестве контаминантов кожи персонала и пациентов [21–24].
Данные отдельных исследований по профилактике ИСМП в кардиохирургических стационарах, включающей введение ежедневной обработкой кожи пациентов 2–4% водным раствором хлоргексидина, свидетельствуют об уменьшении риска возникновения послеоперационных осложнений микробной этиологии при снижении общей обсемененности кожи условно патогенными микроорганизмами [25–35].
Так как для больных, перенесших трансплантацию органов, наибольшую опасность представляют ИСМП, вызванные полирезистентными штаммами Acinetobacter baumannii и Klebsiella pneumoniaе, определенный интерес представляет влияние показателей высеваемости этих контаминантов как с кожи пациентов, так и с окружающих их предметов [36–38].
Цель исследования – оценить значимость контаминации кожных покровов пациентов после ортотопической трансплантации сердца (ОТТС) и окружающей их внешней среды представителями рода Acinetobacter и Klebsiella для риска развития бактериальной инфекции крови (БИК), связанной с этими возбудителями.
Материалы и методы
Исследования проводили в период с января 2013 г. по декабрь 2016 г. В работу включена информация о 194 пациентах после ОТТС, средний возраст которых составлял 45 лет.
Бактериологические исследования для выявления микроорганизмов рода Acinetobacter и/или Klebsiella проводили в ранний послеоперационный период, начиная с третьих суток в течение 2 нед. после операции, так как в этот срок наиболее часто у больных проявлялись первые признаки развития БИК.
У пациентов ежедневно исследовали пробы крови, смывы с кожи (в зоне послеоперационного шва, локтевого сгиба, кистей рук, груди и области прилегания катетеров) на наличие на коже указанных видов микроорганизмов.
Для выявления контаминации объектов внешней среды Acinetobacter и Klebsiella использовали смывы с катетеров, мебели, стоек капельниц, аппаратуры, кранов раковин, постельного белья, а также со спецодежды, защитных масок и кистей рук ухаживающего персонала.
Схемы дезинфекционной обработки оставались стандартными для данного стационара все время проведения исследования и соответствовали нормативным требованиям. Выделение микроорганизмов проводили общепринятыми бактериологическими методами. Для идентификации возбудителей использовали панели BDCristal, базы данных BBLCristalMIND и панели Micrо ScanWalkAway 96 plusSystem (США).
Если хотя бы в одной из сделанных проб обнаруживали Klebsiella или Acinetobacter, пациент считался условно контаминированным.
Для статистической обработки данных использовали программный пакет для ПК Statistica 10 («StatSoft Inc.», США).
Проведен ретроспективный анализ данных пациентов. Сравнение непрерывных переменных и различий пропорций качественных признаков (факторов) осуществляли посредством t-теста Стьюдента и критерия χ2 Пирсона. Двусторонний уровень р < 0,05 выбран для обозначения статистической значимости (общепринятый для медицинских исследований).
Результаты
В работе приведены данные обследования 194 пациентов после ОТТС, которые первоначально составили 2 группы. В 1-ю были включены 132 (68%) пациента с контаминацией кожи и/или внешней среды, во 2-ю – 62 (32%) пациента без контаминации.
В обеих группах были зарегистрированы случаи БИК, связанной с Klebsiella и Acinetobacter: в 1-й группе – у 41 (31,1%) пациента, во 2-й – у 5 (8,1%). У большинства пациентов после проведения ОТТС Klebsiella и/или Acinetobacter выделяли и с кожи, и(или) из внешней среды, при этом в 1-й группе БИК встречалась почти в 4 раза чаще, чем во 2-й.
Для более глубокого анализа влияния контаминации представителями Acinetobacter или Klebsiella на возможность развития БИК, вызванной этими микроорганизмами, среди пациентов 1-й группы были выделены 3 подгруппы в зависимости от наличия контаминации только кожи, только внешней среды и сочетанной контаминации кожи и внешней среды (табл. 1).
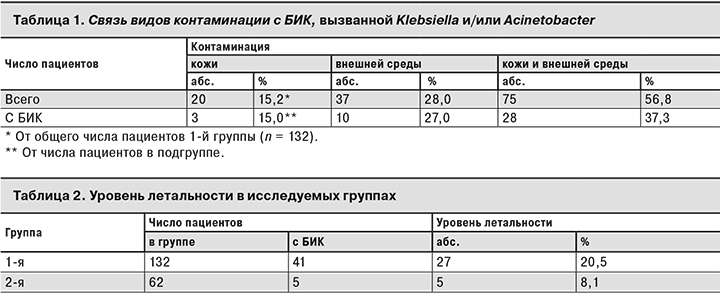
Как видно из табл. 1, у большинства пациентов микроорганизмы Klebsiella и/или Acinetobacter выделяли с кожи и из внешней среды. Контаминированная внешняя среда вокруг пациента увеличивала вероятность возникновения БИК, а присоединение обсеменения кожи приводило к резкому увеличению числа БИК у пациентов.
Необходимо отметить, что в некоторых случаях при развитии БИК у условно контаминированных пациентов из крови выделяли не только Klebsiella и/или Acinetobacter, но и другие микроорганизмы (от 1 до 4 видов), что значительно утяжеляло течение заболевания и вызывало затруднения при проведении антибиотикотерапии.
Как видно из табл. 2, контаминация пациентов Klebsiella и/или Acinetobacter сопутствует увеличению летальности пациентов более чем в 2 раза.
Выводы
- Контаминация кожи представителями рода Acinetobacter или Klebsiella выступает не только как статистически значимый фактор риска, но и как предиктор развития БИК, ассоциированной с этими микроорганизмами.
- Раннее выявление контаминации кожи представляется эффективным прогностическим методом, способствующим корректному подбору схемы антибиотикопрофилактики БИК.
- Активный микробиологический контроль состояния кожи пациентов в раннем послеоперационном периоде поможет предотвратить возникновение БИК в этот период.
* * *
Доложено на Ежегодном конгрессе с международным участием «Контроль и профилактика инфекций, связанных с оказанием медицинской помощи (ИСМП–2017)». Москва, 14–15 ноября 2017 г. (симпозиум «Эпидемиология и профилактика гнойно-септических инфекций в хирургии и реанимации»).
1. Sari B., Baran I., Alaçam S., Mumcuoğlu İ., Kurşun Ş., Aksu N. Investigation of oxacillinase genes in nosocomial multidrug-resistant Acinetobacter baumannii isolatesby multiplex PCR and evaluation of their clonal relationship with Rep-PCR. Mikrobiyol. Bul. 2015; 49(2): 249–58.
2. Pierri M.D., Crescenzi G., Capestro F., Recanatini C., Manso E., D’errico M.M., Prospero E., Barbadoro P., Torracca L. Risk Factors and Impact on Clinical Outcome of Multidrug-Resistant Acinetobacter baumannii Acquisition in Cardiac Surgery Patients. J. Cardiothorac Vasc. Anesth. 2015. pii: S1053-0770(15)00801-0. DOI: 10.1053/j.jvca.2015.08.024.
3. Al-Otaibi F.E., Bukhari E.E., Badr M., Alrabiaa A.A. Prevalence and risk factors of Gramnegative bacilli causing blood stream infection in patients withmalignancy. Saudi Med. J. 2016; 37(9): 979–84. DOI: 10.15537/smj.2016.9.14211
4. Lanini S., Costa A.N., Puro V., Procaccio F., Grossi P.A., Vespasiano F., Ricci A., Vesconi S., Ison M.G., Carmeli Y., Ippolito G; Donor-Recipient Infection (DRIn) Collaborative Study Group. Incidence of carbapenem-resistant gram negatives in Italian transplant recipients: a nationwidesurveillance study. PLoS ONE 2015; 10(4): e0123706.
5. Lin M.F., Tsai P.W., Chen J.Y., Lin Y.Y., Lan C.Y. OmpA Binding Mediates the Effect of Antimicrobial Peptide LL-37 on Acinetobacter baumannii. PLoS ONE 2015; 10(10): e0141107.
6. Kawecki D., Pacholczyk M., Lagiewska B., Sawicka-Grzelak A., Durlik M., Mlynarczyk G., Chmura A. Bacterial and fungal infections in the early post-transplantation period after liver transplantation: etiologic agents and their susceptibility. Transplant. Proc. 2014; 46(8): 2777–81.
7. Ferstl P.G., Filmann N., Brandt C., Zeuzem S., Hogardt M., Kempf V.A., Müller M., Waidmann O., Reinheimer C. The impact of carbapenem resistance on clinical deterioration and mortality in patients with liver disease. Liver Int. 2017. DOI: 10.1111/liv.13438.
8. Ghajavand H., Esfahani B.N., Havaei S.A., Moghim S., Fazeli H. Molecular identification of Acinetobacter baumannii isolated from intensive care units and their antimicrobial resistance patterns. Adv. Biomed. Res. 2015;.4:.110. DOI: 10.4103/2277-9175.157826.
9. Vasudevan A., Mukhopadhyay A., Li J., Yuen E.G., Tambyah P.A. A prediction tool for nosocomial multi-drug Resistant Gram-Negative Bacilli infections in critically ill patients – prospective observational study. BMC Infect. Dis. 2014; 14: 615. DOI: 10.1186/s12879-014-0615-z
10. Perni S., Thenault V., Abdo P., Margulis K., Magdassi S., Prokopovich P. Antimicrobial activity of bone cements embedded with organic nanoparticles. Int. J. Nanomedicine 2015; 10: 6317–29.
11. Lee C.S., Vasoo S., Hu F., Patel R., Doi Y. Klebsiella pneumoniae ST147 coproducing NDM-7 carbapenemase and RmtF 16S rRN Amethyltransferase in Minnesota. J. Clin. Microbiol. 2014; 52(11): 4109–10.
12. Çiçek M., Hasçelik G.I., Müştak H.K., Diker K.S., Şener B. Accurate diagnosis of Pseudomonas luteola in routine microbiology laboratory: on the occasion of two isolates. Mikrobiyol. Bul. 2016; 50(4): 621–4.
13. Rossi F., Girardello R., Cury A.P., Di Gioia T.S., Almeida J.N. Jr, Duarte A.J. Emergence of colistin resistance in the largest university hospital complex of São Paulo, Brazil, over five years. Braz. J. Infect. Dis. 2017; 21(1): 98–101. DOI: 10.1016/j.bjid.2016.09.011
14. Li X., Quan J., Yang Y., Ji J., Liu L., Fu Y., Hua X., Chen Y., Pi B., Jiang Y., Yu Y. Abrp, a new gene, confers reduced susceptibility to tetracycline, glycylcine, chloramphenicol and fosfomycin classes in Acinetobacter baumannii. Eur. J. Clin. Microbiol. Infect. Dis. 2016; 35(8): 1371–5. DOI: 10.1007/s10096-016-2674-0.
15. Lei J., Han S., Wu W., Wang X., Xu J., Han L. Extensively drug-resistant Acinetobacter baumannii outbreak cross-transmitted in an intensive care unit and respiratory intensive care unit. Am. J. Infect. Control. 2016; 44(11): 1280–4. DOI: 10.1016/j.ajic.2016.03.041.
16. Chen Q., Cao H., Lu H., Qiu Z.H., He J.J. Bioprosthetic tricuspid valve endocarditis caused by Acinetobacter baumannii complex, a case report and brief review of the literature. J. Cardiothorac. Surg. 2015; 10: 149. DOI: 10.1186/s13019-015-0377-8.
17. Richmond G.E., Evans L.P., Anderson M.J., Wand M.E., Bonney L.C., Ivens A., Chua K.L., Webber M.A., Sutton J.M., Peterson M.L., Piddock L.J. The Acinetobacter baumannii Two-Component System AdeRS Regulates
18. Genes Required for Multidrug Efflux, Biofilm Formation, and Virulence in a Strain-Specific Manner. mBio 2016; 7(2). pii: e00430-16. DOI: 10.1128/mBio.00430-16.
19. Skowronek P., Wojciechowski A., Leszczyński P., Olszewski P., Sibiński M., Polguj M., Synder M. Can diagnostic ultrasound scanners be a potential vector of opportunistic bacterial infection? Med. Ultrason. 2016; 18(3): 326–31. DOI: 10.11152/mu.2013.2066.183.sko.
20. Bingham J., Abell G., Kienast L., Lerner L., Matuschek B., Mullins W., Parker A., Reynolds N., Salisbury D., Seidel J., Young E., Kirk J. Health care worker hand contamination at critical moments in outpatient care settings. Am. J. Infect. Control. 2016; 44(11): 1198–1202. DOI: 10.1016/j.ajic.2016.04.208
21. Greene C., Vadlamudi G., Eisenberg M.., Foxman B., Koopman J., Xi C. Fomite-fingerpad transfer efficiency (pick-up and deposit) of Acinetobacter baumannii – with and without a latex glove. Am. J. Infect. Control. 2015; 43(9): 928–34. DOI: 10.1016/j.ajic.2015.05.008.
22. Chen C.H., Lin L.C., Chang Y.J., Chen Y.M., Chang C.Y., Huang C.C. Infection Control Programs and Antibiotic Control Programs to Limit Transmission of Multi-Drug Resistant Acinetobacter baumannii Infections: Evolution of Old Problems and New Challenges for Institutes. Int. J. Environ Res. Public. Health. 2015; 12(8): 8871–82. DOI: 10.3390/ijerph120808871.
23. Cheng V.C., Chen J.H., Poon R.W., Lee W.M., So S.Y., Wong S.C., Chau P.H., Yip C.C., Wong S.S., Chan J.F., Hung I.F., Ho P.L., Yuen K.Y. Control of hospital endemicity of multiple-drug-resistant Acinetobacter baumannii ST457 with directly observed hand hygiene. Eur. J. Clin. Microbiol. Infect. Dis. 2015; 34(4): 713–8. DOI: 10.1007/s10096-014-2281-x
24. Ashfaq A., Zhu A., Iyengar A., Wu H., Humphries R., McKinnell J.A., Shemin R., Benharash P. Impact ofan Institutional Antimicrobial Stewardship Program on Bacteriology of Surgical Site Infections in Cardiac Surgery. J. Card. Surg. 2016; 31(6): 367–72. DOI: 10.1111/jocs.12756.
25. Fresnadillo-Martínez M.J.1, García-Merino E., García-Sánchez E., Martín-del Rey Á., Rodríguez-Encinas Á., Rodríguez-Sánchez G., García-Sánchez J.E. Prevention of an outbreak of Acinetobacter baumannii in intensive care units: study of the efficacy ofdifferent mathematical methods. Rev. Esp. Quimioter. 2015; 28(1): 10–20.
26. Shah H.N., Schwartz J.L., Luna G., Cullen D.L. Bathing With 2% Chlorhexidine Gluconate: Evidence and Costs Associated With Central Line-Associated Bloodstream Infections. Crit. Care Nurs. Q. 2016; 39(1): 42–50. DOI: 10.1097/CNQ.0000000000000096.
27. Loveday H.P., Wilson J.A., Pratt R.J., Golsorkhi M., Tingle A., Bak A., Browne J., Prieto J., Wilcox M. Epic3: national evidence-based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J. Hosp. Infect. 2014; 86(Suppl. 1): S1–70. DOI: 10.1016/S0195-6701(13)60012-2.
28. Huang H.P., Chen B., Wang HY., He M. The efficacy of daily chlorhexidine bathing for preventing healthcare-associated infections in adult intensive care units. Korean J. Intern. Med. 2016; 31(6): 1159–170.
29. Cassir N., Thomas G., Hraiech S., Brunet J., Fournier P.E., La Scola B., Papazian L. Chlorhexidine daily bathing: impact on health care-associated infections caused by gram-negative bacteria. Am. J. Infect. Control. 2015; 43(6): 640–3. DOI: 10.1016/j.ajic.2015.02.010.
30. Musuuza J.S., Roberts T.J., Carayon P., Safdar N. Assessing the sustainability of daily chlorhexidine bathing in the intensive care unit of a Veteran’s Hospital by examining nurses’ perspectives and experiences. BMC Infect. Dis. 2017; 17(1): 75. DOI: 10.1186/s12879-017-2180-8
31. Afonso E., Blot K., Blot S. Prevention of hospital-acquired bloodstream infections through chlorhexidine gluconate-impregnated washcloth bathing in intensive care units: a systematic review and meta-analysis of randomised crossover trials. Euro Surveill. 2016; 21(46). pii: 30400. DOI: 10.2807/1560-7917.ES.2016.21.46.30400.
32. Cassir N., Papazian L., Fournier P.E., Raoult D., La Scola B. Insights into bacterial colonization of intensive care patients’ skin: the effect of chlorhexidine daily bathing. Eur. J. Clin. Microbiol. Infect Dis. 2015; 34(5): 999–1004. DOI: 10.1007/s10096-015-2316-y.
33. Denny J., Munro C.L. Chlorhexidine Bathing Effects on Health-Care-Associated Infections. Biol. Res. Nurs. 2017; 19(2): 123–36. DOI: 10.1177/1099800416654013.
34. Swan J.T., Ashton C.M., Bui L.N., Pham V.P., Shirkey B.A, Blackshear J.E., Bersamin J.B., Pomer R.M., Johnson M.L., Magtoto A.D., Butler M.O., Tran S.K., Sanchez L.R., Patel J.G., Ochoa R.A. Jr, Hai S.A., Denison K.I., Graviss E.A., Wray N.P.. Effect of Chlorhexidine Bathing Every Other Day on Prevention of Hospital-Acquired Infections in the Surgical ICU: A Single-Center, Randomized Controlled Trial. Crit. Care Med. 2016; 44(10): 1822–32. DOI: 10.1097/CCM.0000000000001820.
35. Duszyńska W., Adamik B., Lentka-Bera K., Kulpa K., Nieckula-Schwarz A., Litwin A., Stróżecki Ł., Kübler A. Effect of universal chlorhexidine decolonisation on the infection rate in intensive care patients. Anaesthesiol. Intensive Ther. 2017; 49(1): 28–33. DOI: 10.5603/AIT.2017.0007.
36. Gupta T.T., Karki S.B., Matson J.S., Gehling D.J., Ayan H. Sterilization of Biofilm on a Titanium Surface Using a Combination of Nonthermal Plasma and Chlorhexidine Digluconate. Biomed. Res. Int. 2017; 6085741. DOI: 10.1155/2017/6085741
37. Романова Н.И., Горская Е.М., Есенова Н.М., Захаревич В.М., Саитгареев Р.Ш., Габриэлян Н.И.. Микрофлора внешней среды как угроза развития инфекционной патологии у пациентов после ортотопической трансплантации сердца. Медицинский алфавит 2016; 1(6): 47–55.
38. Габриэлян Н.И., Арефьева Л.И., Горская Е.М., Драбкина И.В., Есенова Н.М., Романова Н.И., Федорова Л.С. К проблеме предупреждения госпитальных инфекций в условиях развития антибиотикорезистентности патогенов. Дезинфекционное дело 2015; (2): 25–31.
39. Габриэлян Н.И., Горская Е.М., Драбкина И.В., Савостьянова О.А., Ромашкина Л.Ю., Захаревич В.М., Саитгареев Р.Ш. Бактериемии госпитального периода после кардиохирургических операций. Российский медицинский журнал 2015; 21(5): 17–21
Габриэлян Нина Индзаровна – д.м.н., доцент, заведующая отделом эндотоксикозов и гнойно-септических осложнений ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова» Минздрава России
Адрес: 123182, Москва, ул. Щукинская, д. 1
Драбкина Ирина Васильевна – врач-бактериолог лаборатории бактериологии отдела эндотоксикозов и гнойно-септических осложнений ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова» Минздрава России; e-mail:
Захаревич Вячеслав Мефодьевич – д.м.н., главный научный сотрудник, врач-хирург ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова» Минздрава России; e-mail:
Саитгареев Ринат Шакирьянович – д.м.н., профессор, заведующий кардиохирургическим отделением № 3 ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова» Минздрава России; e-mail:
Сафонова Татьяна Борисовна – к.м.н., доцент кафедры микробиологии ФГБОУ ДПО «Российская медицинская академия непрерывного последипломного образования» Минздрава России; e-mail:
Петрухина Марина Ивановна – к.м.н., доцент кафедры эпидемиологии ФГБОУ ДПО «Российская медицинская академия непрерывного последипломного образования» Минздрава России; e-mail:
Шарапченко Софья Олеговна – лаборант-исследователь отдела эндотоксикозов и гнойно-септических осложнений ФГБУ «Национальный медицинский исследовательский центр трансплантологии и искусственных органов имени академика В.И. Шумакова» Минздрава России; e-mail:




